
| A. | CaCl2 | B. | KCl | C. | AlCl3 | D. | SnCl4 |
分析 溶液中溶质的物质的量为:n=c•V,等体积、等浓度的下列溶液,可知溶液中溶质的物质的量相等,然后根据溶质的组成进行分析含有Cl-数即可.
解答 解:溶质的物质的量为:n=c•V,由于等体积、等浓度的下列溶液,所以溶液中溶质的物质的量相等,根据N=n•NA,所含溶质的Cl-数目与溶质的化学式有关,溶质的化学式中含有的Cl-数越少,溶液中Cl-数目越小,离子化学式CaCl2、KCl、AlCl3、SnCl4中,KCl含有的Cl-数最少,
故选B.
点评 本题考查了物质的量浓度,题目难度不大,注重了基础知识的考查,注意掌握物质的量浓度概念,本题旨在培养学生灵活运用基础知识解决实际问题的能力.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 | 初始pH | V(KMnO4)/mL | V(H2C2O4)/mL | V(H2O)/mL |
| ① | 4 | 20 | 10 | |
| ② | 5 | 10 | 5 | |
| ③ | 20 | 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
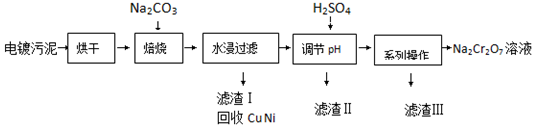
| 20℃ | 60℃ | 100℃ | |
| Na2SO4 | 19.5 | 45.3 | 42.5 |
| Na2Cr2O7 | 183 | 269 | 415 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4、9、24、14、28 | B. | 1、1、1、1、2 | C. | 8、9、12、10、20 | D. | 任意比均可 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
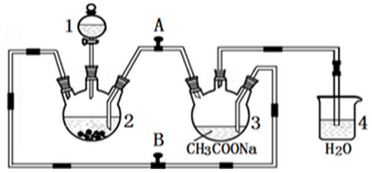
 溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
 +Br2$\stackrel{Fe}{→}$
+Br2$\stackrel{Fe}{→}$ +HBr.
+HBr.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要选择适宜的条件,SO2和O2就能全部转化为SO3 | |
| B. | 该反应达到平衡后,反应就停止了,即正逆反应速率为零 | |
| C. | 在达到平衡的体系中,充入O2,对化学平衡无影响 | |
| D. | 在工业合成SO3时,要同时考虑反应速率和反应所能达到的限度两个方面的问题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com