
| A、3s23p1 |
| B、2s22p2 |
| C、3s2 |
| D、4s24p3 |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu+HNO3(浓)→Cu(NO3)2 | |||||
| B、Cu+HNO3(稀)→Cu(NO3)2 | |||||
C、Cu
| |||||
D、Cu
|
查看答案和解析>>
科目:高中化学 来源: 题型:
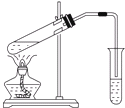
| A、用如图所示装置,只用无水乙酸和乙醇共热就能制取乙酸乙酯 |
| B、将苯逐滴滴入浓溴水中,充分反应后就能制取溴苯 |
| C、将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复原来的红色 |
| D、将苯逐滴滴入酸性高锰酸钾溶液中,溶液最终褪成无色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
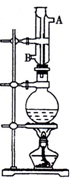 实验室利用如图中装置制取乙酸异戊酯,其合成过程为:
实验室利用如图中装置制取乙酸异戊酯,其合成过程为:查看答案和解析>>
科目:高中化学 来源: 题型:
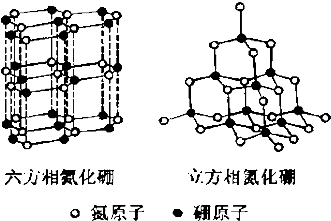 氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.
氮化硼(BN)晶体有多种相结构.六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作高温润滑剂.立方相氮化硼是超硬材料,有优异的耐磨性.它们的晶体结构如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下将等体积等物质的量浓度的醋酸钠与盐酸两溶液混合:c(Na+)>c(CH3COO-)>c(CH3COOH)>c(H+)>c(OH-) |
| B、向NH4HSO4溶液中滴加含等物质的量溶质的NaOH溶液:c(Na+)=c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| C、在0.1mol/L(NH4)2Fe(SO4)2溶液中:c(H+)+c(NH4+)+2c(Fe2+)=c(OH-)+c(SO42-) |
| D、pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com