
| A. | 1:1 | B. | 1:2 | C. | 1:3 | D. | 3:1 |
分析 发生2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑,产生的氢气的体积比为1:1,参加反应的Al相同,结合反应计算消耗的酸碱,以此来解答.
解答 解:产生的气体在同条件下的体积比为1:1,则生成氢气相同,设均生成3molH2,则
2Al+6HCl=2AlCl3+3H2↑
6mol 3mol
2Al+2NaOH+2H2O=2NaAlO2+3H2↑
2mol 3mol
则消耗的盐酸和氢氧化钠的物质的量的比为6mol:2mol=3:1,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应、反应中物质的量关系为解答的关键,侧重分析与计算能力的考查,注意巧设数据简化计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用氯化铁或液氯处理废水 | |
| B. | 用铁槽车或铝槽车运输浓硫酸 | |
| C. | 用二氧化硫或氯气漂自织物 | |
| D. | 用亚硫酸钠或氯水处理二氧化硫尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1 g 37Cl2含有的中子数为4NA | |
| B. | NA个Al(OH)3胶体粒子的质量为78 g | |
| C. | 7.8 g Na2O2晶体中阴阳离子总数为0.3NA | |
| D. | 标准状况下,2.24 L己烷含有的共价键数为1.9NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
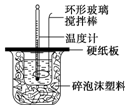 某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:
某实验小组设计用50mL 1.0mol/L盐酸跟50mL 1.1mol/L 氢氧化钠溶液在如图装置中进行中和反应.在大烧杯底部垫碎泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平.然后再在大、小烧杯之间填满碎泡沫塑料(或纸条),大烧杯上用泡沫塑料板(或硬纸板)作盖板,在板中间开两个小孔,正好使温度计和环形玻璃搅拌棒通过.通过测定反应过程中所放出的热量可计算中和热.试回答下列问题:| 实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF的电离方程式及热效应:HF(aq)?H+(aq)+F-(aq)△H>0 | |
| B. | 在氢氧化钠溶液与盐酸的反应中,氢氧化钠溶液量越多,中和热越大 | |
| C. | △H2=-57.3 kJ•mol-1是强酸和强碱在稀溶液中反应生成可溶盐的中和热 | |
| D. | 稀硫酸与稀氢氧化钡溶液反应的热化学方程式为H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l)△H=-114.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
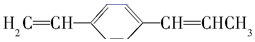 的说法正确的是( )
的说法正确的是( )| A. | 所有原子都在同一平面上 | |
| B. | 最多有4个碳原子在同一直线上 | |
| C. | 有7个碳原子可能在同一直线上 | |
| D. | 最多只能有9个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
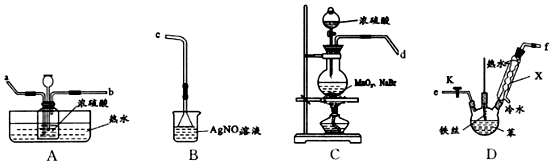
 ;仪器X的名称为球形冷凝管.
;仪器X的名称为球形冷凝管. ?
?
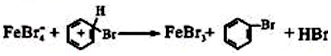 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com