
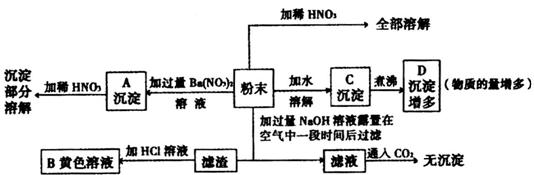
(1)粉末中一定有______________________________________________;
(2)粉末中一定没有____________________________________________;
(3)沉淀A加稀硝酸部分溶解的离子方程式为__________,____________;
(4)B中的溶液显黄色是因为含有________________________________;
(5)D沉淀中增多的成分是______________,由C到D沉淀增多的原因是________________。
科目:高中化学 来源: 题型:
(09盐城第三次调研)CaO2?8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气,425℃分解完全。过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。实验室先用大理石(含MgCO3、FeCO3等杂质)制取纯净的碳酸钙,然后再用纯的碳酸钙制取过氧化钙。实验流程如下(已知:Ca(OH)2+H2O2+6H2O→CaO2?8H2O △H<0):
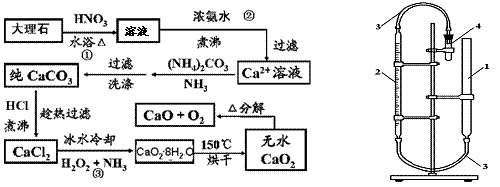
(1)写出CaO2的电子式: 。
(2)图示步骤②,加入浓氨水至弱碱性的目的是: 。
(3)步骤③发生反应的化学方程式为: 。
(4)步骤③用冰水冷却的可能原因是: 。
(5)用右上图的量气法可测定样品中CaO2的质量分数:先检查装置的气密性,然后在量气管中注入一定量的水,在仪器4的试管中注入9.0g样品,连接好装置;充分加仪器4所示的小试管。若在标准状况下收集到840mL气体,则CaO2纯度为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com