
常温下,浓度均为0.1 mol/L 的下列四种盐溶液,其pH测定如下表所示:
| 序号 | ① | ② | ③ | ④ |
| 溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
| pH | 8.8 | 9.7 | 11.6 | 10.3 |
下列说法正确的是( )
A.四种溶液中,水的电离程度①>②>④>③
B.Na2CO3和NaHCO3溶液中,粒子种类相同
C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClO
D.Na2CO3溶液中, c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应:___________________________
________________________________________________________________________。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是_________________________________________________________________
________________________________________________________________________。
(3)吸收液吸收SO2的过程中,pH随n(SO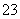 )∶n(HSO
)∶n(HSO )变化关系如下表:
)变化关系如下表:
| n(SO | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
①由上表判断,NaHSO3溶液显________性,用化学平衡原理解释:_____________。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母):________。
a.c(Na+)=2c(SO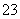 )+c(HSO
)+c(HSO )
)
b.c(Na+)>c(HSO )>c(SO
)>c(SO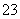 )>c(H+)=c(OH-)
)>c(H+)=c(OH-)
c.c(Na+)+c(H+)=c(SO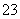 )+c(HSO
)+c(HSO )+c(OH-)
)+c(OH-)
(4)(201 2·福建高考节选)能证明Na2SO3溶液中存在SO
2·福建高考节选)能证明Na2SO3溶液中存在SO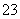 +H2OHSO
+H2OHSO +OH-水解平衡的事实是________(填序号)。
+OH-水解平衡的事实是________(填序号)。
A.滴入酚酞溶液变红 ,再加入H2SO4溶液后红色褪去
,再加入H2SO4溶液后红色褪去
B.滴入酚酞溶液变红,再加入氯水后红色褪去
C.滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
将某溶液逐滴加入到氢氧化铁胶体中,开始产生沉淀,后又溶解的是( )
A.2 mol·L-1的氢氧化钠溶液 B.2 mol·L-1的硫酸溶液
C.2 mol·L-1的硫酸镁溶液 D.2 mol·L-1的乙醇溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
能正确表示下列反应的离子反应方程式为( )
A.NH4HCO3溶于过量的浓KOH溶液中:NH4++ HCO3-+2OH-= CO32-+ NH3↑+2 H2O
B.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-沉淀完全:
2Al3++3SO42-+3Ba2++6OH -=2 Al(OH)3↓+3BaSO4↓
C.向FeBr2溶液中通入少量氯气:2Fe2++4Br-+3Cl2=2 Fe3++2 Br2+6 Cl-
D.醋酸除去水垢:2H++CaCO3=Ca2++ CO2↑+ H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关说法正确的是( )
A.反应NH3(g)+HCl(g)=== NH4Cl(s)在室温下可自发进行,则该反应的△H>0
B.电解法精炼铜时,以粗铜作阴极,纯铜作阳极
C.CH3COOH 溶液加水稀释后,溶液中 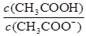
的值减小
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
请回答下列问题:
(1)该反应平衡常数表达式为K=______ ;ΔH 0(选填“>”、“<”或“=”)。
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,若测得反应初始至6 S内A的平均反应速率v(A)=0.003 mol · L-1· S-1,则6 S时c(A)=______ mol·L-1;C的物质的量为______ mol 。
(3)在与(2)相同的温度、容器及A、B配比下反应经一段时间后达到平衡,此时A的转化率为______;如果这时向该密闭容器中再充入1 mol氩气,则平衡时A的转化率_ (选填“增大”、“减小”、“不变”)。
(4)判断该反应是否达到平衡的依据为______(填正确选项的字母)。
a.压强不随时间改变 b.气体的密度不随时间改变
c.c(A)不随时间改变 d.单位时间里生成C和D的物质的量相等
(5)1200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为______ 。
A(g)+B(g)的平衡常数的值为______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于物质性质的说法不合理的是
A.金属Mg与稀硫酸和CO2均能反应,其反应类型相同
B.FeCl3、Na2O2、Cu2S均可由相应单质直接化合生成
C.SO2气体通入紫色石蕊试液中,溶液先变红后褪色
D.氢氧化铝、碳酸铵、碳酸氢钠、甘氨酸都既能与盐酸反应,又能与氢氧化钠溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
为验证氧化性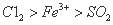 ,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
,某小组用下图所示装置进行实验(夹持仪器和甲中加热装置已略,气密性已检验)。
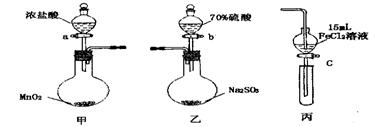
实验步骤:
1.在甲装置中,打开活塞a,加热,待装置中充满黄绿色气体时,与丙装置连接。
2.当丙装置中FeC12溶液变黄时,停止加热。
3.打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
4.在乙装置中,打开活塞b,待空气排尽后,将乙中产生的气体通入上述丙装置变黄后的溶液中,一段时间后,停止。
5.更新丙中试管,打开活塞c,使约2mL的溶液滴入试管中,检验溶液中的离子。
回答下列问题:
(1)甲中发生反应的化学方程式为______________________。
(2)用70%的硫酸制取SO2,反应速率比用98%的硫酸快,原因是_______ _____。
(3)实验中,证明氧化性Fe3+>SO2的离子方程式为______ _______。
(4)有I、II、III三组同学分别完成了上述实验,实验结果如下:
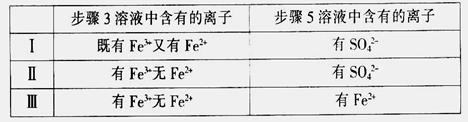
上述实验结果一定能够证明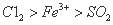 的是______(填“I”、“II”或“III”)。
的是______(填“I”、“II”或“III”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是
( )
A.炔烃分子中所有的碳原子都在同一条直线上
B.分子组成符合CnH2n-2通式的链烃,一定是炔烃
C.炔烃既易发生加成反应,又易发生取代反应
D.炔烃既可使溴水褪色,又可使KMnO4酸性溶液褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com