

 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$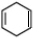 +NaBr+H2O
+NaBr+H2O分析 4-溴环己烯含有碳碳双键,可被与HBr发生加成反应,可被酸性高锰酸钾氧化,含有Br原子,可发生水解和消去反应,以此解答该题.
解答 解:(1) 含官能团为碳碳双键、溴原子,故答案为:碳碳双键;溴原子;
含官能团为碳碳双键、溴原子,故答案为:碳碳双键;溴原子;
(2)反应①中 含碳碳双键,可被酸性高锰酸钾氧化,生成物为HOOCCH2CHBrCH2CH2COOH,为氧化反应;
含碳碳双键,可被酸性高锰酸钾氧化,生成物为HOOCCH2CHBrCH2CH2COOH,为氧化反应;
反应②为水解反应,-Br水解转化为-OH,
故答案为:氧化反应;水解反应;
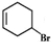
(3)③为消去反应,方程式为 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O,
+NaBr+H2O,
故答案为: +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaBr+H2O;
+NaBr+H2O;
(4)④为加成反应,方程式为 +HBr$\stackrel{一定条件}{→}$
+HBr$\stackrel{一定条件}{→}$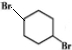 ,生成物为溴代烃,
,生成物为溴代烃,
故答案为:溴代.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃、卤代烃的性质,题目难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向硅酸钠溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色褪去 | 2min 后,试管里出现凝胶 | 酸性:盐酸>硅酸 |
| B | 常温下,向浓硝酸中投入铁片 | 铁片不溶解 | 常温下,铁不与浓硝酸反应 |
| C | 在酒精灯上加热铝箔 | 铝箔熔化但不滴落 | 熔点;氧化铝>铝 |
| D | 向某溶液中先滴加KSCN溶液,再滴加少量氯水 | 先无明显现象,后溶液变成红色 | 溶液中含有Fe2+,没有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 120℃时,若反应前混合气体共NA个分子,反应后气体分子可能大于NA | |
| B. | 0℃时,若生成2.24L气体,则转移电子数一定为0.8NA | |
| C. | 若NA个CH4分子参加反应,则有 2NA个O-H生成 | |
| D. | 0℃时,若NA个CH4分子和足量O2完全反应,则生成气体体积为67.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在101 kPa时,2 g H2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 500℃、30 MPa下,将0.5 mol N2(g)和1.5 mol H2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
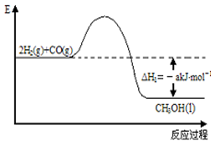 能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热
能源是人类生存和发展的重要支柱.研究并有效地开发新能源在能源紧缺的今天具有重要的理论意义.已知H2与CO反应生成CH3OH的过程如图所示:CO的燃烧热△H2=-b kJ•mol-1,CH3OH的燃烧热 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com