
【题目】亚铁氰化钠晶体[Na4Fe(CN)6·10H2O,M=484g·mol-1]可用作食盐抗结剂。请回答
(1)向Na4Fe(CN)6溶液中滴入FeCl3溶液,出现蓝色沉淀,其离子方程式为______________。
(2)已知:Ag4Fe(CN)6为白色难溶物, Cu2Fe(CN)6为红棕色难溶物。市售亚铁氰化钠常含有Cl-杂质,选用下列试剂设计实验方案进行Cl-检验。
试剂:稀HNO3、稀H2SO4、AgNO3溶液、CuSO4溶液、Na2CO3溶液、H2O2溶液
实验步骤 | 现象 |
①取少量样品,加入蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③_______ | ④______ |
⑤静置,_____ | ⑥出现白色浑浊 |
(3)利用铈量法测定亚铁氰化钠晶体纯度的实验如下:称取1.2100g样品,置于500mL仪器a中,加入25mL除氧蒸馏水,加入25mL浓硫酸酸化并冷却,滴加3滴橘红色邻二氮菲(phen)—FeSO4指示剂,用0.1000mo1·L-1的Ce(SO4)2标准溶液滴定,发生反应:Ce4++[Fe(CN)6]4-=Ce3++[Fe(CN)6]3-。当溶液从橘红色变为淡黄色,即为终点。平行滴定3次,标准溶液的平均用量为24.50mL。
①仪器a的名称为_________________。
②“浓硫酸酸化”的实验操作为______________________
③样品纯度为__________________%
【答案】4Fe3++3[Fe(CN)6]4-=Fe4[Fe(CN)6]3↓ 加入过量CuSO4溶液 出现红棕色沉淀 取上层清液,加入过量稀硝酸酸化,然后加入AgNO3溶液 锥形瓶 沿瓶壁缓缓加入浓硫酸,并不断搅拌 98
【解析】
(2)本实验的目的是检验Clˉ,一般通过氯离子和银离子可以生成不溶于酸的白色沉淀来检验氯离子,但根据题目信息可知Ag4Fe(CN)6为白色难溶物,会干扰氯离子的检验,所以需要先将[Fe(CN)6]4ˉ除去,根据提供的试剂,可以用过量的硫酸铜将[Fe(CN)6]4ˉ沉淀除去,然后取上层清液检验是否含有氯离子。
(1)该蓝色沉淀应为Fe4[Fe(CN)6]3,根据电荷守恒可得离子方程式为4Fe3++3[Fe(CN)6]4ˉ=Fe4[Fe(CN)6]3↓;
(2)根据分析可知需要先用过量硫酸铜将[Fe(CN)6]4ˉ除去,所以步骤③为加入过量CuSO4溶液;现象④为出现红棕色沉淀;之后取上层清液用酸化的硝酸银检验氯离子,所以步骤⑤为静置,取上层清液,加入过量稀硝酸酸化,然后加入AgNO3溶液;
(3)①滴定时待测液放在锥形瓶中,所以仪器a为锥形瓶;
②浓硫酸稀释时会放热,为了防止暴沸,浓硫酸酸化时需要沿瓶壁缓缓加入浓硫酸,并不断搅拌;
③标准溶液的平均用量为24.50mL,浓度为0.1000mo1·L-1,根据发生的离子方程式可知n{[Fe(CN)6]4-}=n(Ce4+)=0.0245L×0.1000mo1·L-1=0.00245mol,所以样品的纯度为![]() =98%。
=98%。


科目:高中化学 来源: 题型:
【题目】对于CO2+3H2![]() CH3OH+H2O,下列说法能判断该反应达到平衡状态的是
CH3OH+H2O,下列说法能判断该反应达到平衡状态的是
A. v(CO2)= ![]() v(H2) B. 3v逆(H2)=v 正(H2O)
v(H2) B. 3v逆(H2)=v 正(H2O)
C. v正(H2)=3v逆(CO2) D. 断裂 3molH-H 键的同时,形成 2molO-H 键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①CO(g)+CuO(s)![]() CO2(g)+Cu(s)和反应②H2(g)+CuO(s)
CO2(g)+Cu(s)和反应②H2(g)+CuO(s)![]() Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)
Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2,该温度下反应③CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A. 反应①的平衡常数K1=c(CO2).c(Cu)/c(CO).c(CuO)
B. 反应③的平衡常数K=K1/K2
C. 对于反应③,恒容时,温度升高,H2浓度减小,则该反应的焓变为正值
D. 对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2.0molPCl3和1.0molCl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g)PCl5(g)达平衡时,PCl5为0.4mol,如果此时移走1.0molPCl3和0.50molCl2,在相同温度下再达平衡时PCl5的物质的量是( )
A. 0.4mol
B. 0.2mol
C. 小于0.2mol
D. 大于0.2mol,小于0.4mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度和压强下,合成氨反应:N2(g)+3H2(g)=2NH3(g) ΔH=-92.0 kJ/mol,将1 mol N2和3 mol H2充入一密闭容器中,保持恒温恒压,在催化剂存在时进行反应,达到平衡时,测得N2的转化率为20%。若在相同条件下,起始时向该容器中充入2 mol NH3,反应达到平衡时的热量变化是( )
A.吸收18.4 kJ热量B.吸收73.6 kJ热量
C.放出18.4 kJ热量D.放出73.6 kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将甲烷与氯气按1:3的体积比混合于一试管中,倒立于盛有饱和食盐水的水槽,置于光亮处(如图所示),下列有关此实验的现象和结论的叙述不正确的是( )
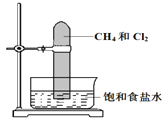
A. 试管中气体的黄绿色逐渐变浅,水面上升
B. 生成物只有三氯甲烷和氯化氢在标准状况下是气体
C. 试管内壁有油状液滴形成
D. 试管内有少量白雾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯和液溴的取代反应的实验装置如图所示,其中A为具支试管改制成的反应容器,在其下端开了一小孔,塞好石棉绒,再加入少量铁屑。填写下列空白:
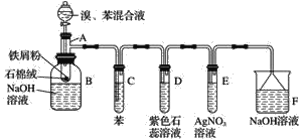
(1)写出A中主要反应的化学方程式:___________
(2)试管C中苯的作用是______________。反应开始后,观察试管D和试管E,看到的现象分别为D____________E____________。
(3)仪器B中的NaOH溶液的作用是____________,可观察到的现象是________。
(4)在上述整套装置中,具有防倒吸作用的装置有__________(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应2A+3B![]() C+2D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此可推断( )
C+2D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此可推断( )
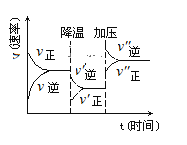
A.正反应是放热反应
B.逆反应是吸热反应
C.若C、D是气体,则B是液体或固体
D.A、B、C、D均为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。所用HNO3浓度为1.00 mol/L、2.00 mol/L,大理石有细颗粒和粗颗粒两种规格,实验温度为25℃、35℃,每次实验HNO3的用量为25.00 mL,大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填空:
实验编号 | 温度(℃) | 大理石规格 | HNO3浓度(mol/L) | 实验目的 |
① | 25 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究浓度对反应速率的影响; (Ⅱ)实验①和③探究温度对反应速率的影响; (Ⅲ)实验①和④探究e_______对反应速率的影响 |
② | 25 | 粗颗粒 | a______ | |
③ | b_______ | 粗颗粒 | 2.00 | |
④ | c________ | 细颗粒 | d______ |
(2)实验①中CO2质量随时间变化的关系见下图。计算实验①中70 s~90 s范围内用HNO3表示的平均反应速率________(忽略溶液体积变化,不需要写出计算过程)。在0~70、70~90、90~200各相同的时间段里,反应速率最大的时间段是________。
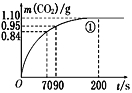
(II)某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1 | 0.6mol·L-1H2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(3)表中V1=_______mL,V2=_______mL。
(4)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(5)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com