
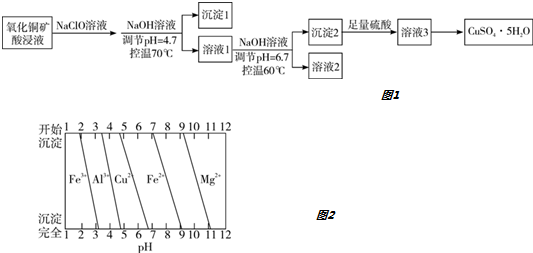
| A. | 沉淀1的主要成分为Al(OH)3和Fe(OH)3 | |
| B. | 溶液2中所含金属阳离子只有Mg2+ | |
| C. | 将溶液3蒸干即得CuSO4•5H2O晶体 | |
| D. | 若不加入NaClO溶液,对制得硫酸铜晶体的纯度将无影响 |
分析 氧化铜矿用稀硫酸溶解后所得酸浸液(含Cu2+、H+、SO42-、Mg2+、A13+、Fe2+),加NaClO溶液,把亚铁离子氧化为Fe3+,调节溶液的pH=4.7,由各金属离子沉淀的pH图可知,A13+、Fe3+转化为Al(OH)3和Fe(OH)3沉淀,过滤,沉淀1为Al(OH)3和Fe(OH)3,溶液1含有Cu2+、H+、SO42-、Mg2+,然后加NaOH,调节pH=6.7,Cu2+转化为Cu(OH)2沉淀,过滤,沉淀2为Cu(OH)2,溶液2主要含有Mg2+,Cu(OH)2加硫酸生成溶液3为硫酸铜溶液,然后加热浓缩、冷却结晶得到硫酸铜晶体;据此分析.
解答 解:氧化铜矿用稀硫酸溶解后所得酸浸液(含Cu2+、H+、SO42-、Mg2+、A13+、Fe2+),加NaClO溶液,把亚铁离子氧化为Fe3+,调节溶液的pH=4.7,由各金属离子沉淀的pH图可知,A13+、Fe3+转化为Al(OH)3和Fe(OH)3沉淀,过滤,沉淀1为Al(OH)3和Fe(OH)3,溶液1含有Cu2+、H+、SO42-、Mg2+,然后加NaOH,调节pH=6.7,Cu2+转化为Cu(OH)2沉淀,过滤,沉淀2为Cu(OH)2,溶液2主要含有Mg2+,Cu(OH)2加硫酸生成溶液3为硫酸铜溶液,然后加热浓缩、冷却结晶得到硫酸铜晶体;
A.由流程分析可知,沉淀1的主要成分为Al(OH)3和Fe(OH)3,故A正确;
B.溶液2主要含有Mg2+,还有少量的Cu2+、A13+、Fe3+,因为Cu2+、A13+、Fe3+不能全部转化为沉淀,故B错误;
C.从溶液中提取溶质时,加热浓缩、冷却结晶,不能加热干,故C错误;
D.若不加入NaClO溶液,在调节pH=4.7时,Fe2+不能转化为沉淀,在调节pH=6.7,Cu2+转化为Cu(OH)2沉淀,而此时Fe2+不能转化为沉淀,所以对制得硫酸铜晶体的纯度将无影响,故D正确.
故选AD.
点评 本题考查了物质的分离提纯的综合应用,明确分离提纯操作流程是解本题关键,侧重对学生能力的培养和训练,有利于培养学生灵活运用知识解答问题的能力,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 植物油与聚乙烯均能使溴水褪色 | |
| B. | 淀粉与纤维素均为高分子化合物且互为同分异构体 | |
| C. | 蔗糖与麦芽糖的水解产物均为葡萄糖 | |
| D. | 丙烷与2-甲基丙烷的一氯代物均为两种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO3 | B. | NO2 | C. | Al2O3 | D. | SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
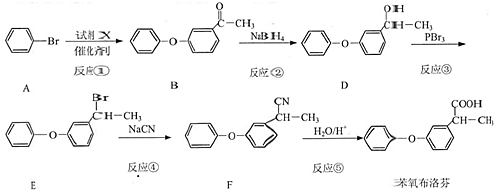
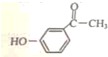 .
.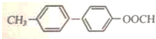 .
.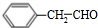 为原料制备
为原料制备 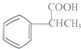 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: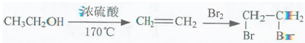
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在酸性介质中钢铁容易发生析氢腐蚀,随着pH升高发生吸氧腐蚀的几率增大 | |
| B. | 电解水制氢比光催化还原水制氢更节能环保、更经济 | |
| C. | 青蒿素在超临界CO2中有很强的溶解性,萃取青蒿素时可用超临界CO2作萃取剂 | |
| D. | 钙基固硫和NOx的催化转化都是解决空气污染问题的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用米汤检验碘盐中的碘 | |
| B. | 用热的烧碱溶液洗涤餐具上的油污 | |
| C. | “地沟油”禁止食用,但可用来制取肥皂 | |
| D. | 将洁厕灵与84消毒液混合使用,能更有效的起到洁具除垢和卫生消毒作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题:
A、B、C、D、E为原子序数依次增大的五种元素,A的一种同位素可用于考古中测定生物的死亡年代; B与A同周期,其s能级电子数比p能级电子数多;C原子的最外层电子数是次外层的3倍;D与B同主族;E的原子序数为29.回答下列问题: .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
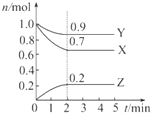 某温度时,在2L 容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示.
某温度时,在2L 容器中,X、Y、Z三种物质的物质的量随时间的变化曲线如图所示. 查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验得到的NaCl中无其他任何杂质 | |
| B. | 检验所得NaCl中是否混有BaCl2,可用AgNO3溶液检验 | |
| C. | 该实验基本操作分为溶解、过滤和蒸发三个步骤 | |
| D. | 除去杂质时,不必考虑所加试剂的顺序 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com