
| A | B | C | D | |
| 强电解质 | HCl | 酒精 | CH3COOH | NaCl |
| 弱电解质 | NH3•H2O | HClO | BaSO4 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
分析 在水溶液或熔融状态下能够导电的化合物为电解质,在水溶液和熔融状态下都不能导电的化合物为非电解质;
在水溶液中完全电离的电解质为强电解质,部分电离的电解质为弱电解质,据此进行判断.
解答 解:A、强酸属于强电解质,HCl是强电解质,一水合氨是弱碱,弱碱属于弱电解质,故A正确;
B、酒精在水溶液中和软化状态下均不能导电,属于非电解质,故B错误;
C、醋酸属于弱酸,是弱电解质,硫酸钡属于盐,是强电解质,故C错误;
D、NaCl和NaOH分别属于盐和强碱,均属于强电解质,故D错误,故选A.
点评 本题考查了电解质与非电解质、强电解质与弱电解质的判断,题目难度不大,注意掌握强弱电解质、电解质与非电解质的概念及判断方法,明确电解质强弱的根本区别是电离的程度.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下1L 0.1 mol•L-1 NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1mol H2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 以Mg、Al为电极,NaOH溶液为电解质溶液的原电池中,导线上流过NA个电子,则正极放出H2的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 仅含有Na+、H+、OH-、CH3COO-四种离子的某溶液中存在:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| B. | 0.1 mol•L-1NaHCO3溶液与0.1 mol•L-1NaOH溶液等体积混合:c(Na+)=2c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+2c(H2CO3) | |
| C. | 0.1 mol•L-1NaHCO3溶液与0.2 mol•L-1NaOH溶液等体积混合:c(Na+)>c(OH-)>0.05 mol•L-1>c(CO${\;}_{3}^{2-}$)>c(HCO${\;}_{3}^{-}$) | |
| D. | pH=4.75、浓度均为0.1mol•L-1的CH3COOH和CH3COONa混合溶液:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | E | F | ||||||
| 3 | A | C | D | G | R | |||
| 4 | B | H |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| B. | 催化剂可以使不起反应的物质发生反应 | |
| C. | 可以找到一种催化剂使水变成汽油 | |
| D. | 催化剂是决定化学反应速率的主要因素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化钠溶液,在阴极析出钠 | |
| B. | 电解熔融氯化镁制取镁时,阴极和阳极生成的产物物质的量之比为1:1 | |
| C. | 电解稀硫酸,在阴极和阳极分别产生氧气和氢气 | |
| D. | 电解熔融氧化铝过程中,若有3.01×1024个电子转移,则生成1mol铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
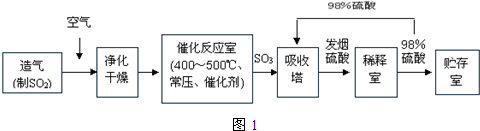
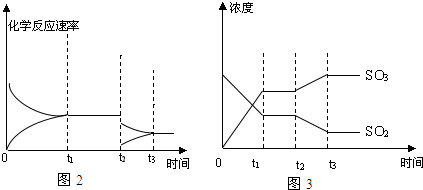
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com