
| A. | 有白色沉淀生成 | |
| B. | 有红棕色沉淀生成 | |
| C. | 没有沉淀生成 | |
| D. | 既有红褐色沉淀生成又有无色气体产生 |
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:选择题
| A. | 50 s | B. | 30 s | C. | 5 s | D. | 1 s |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同温同压下,相同体积的物质,它们的物质的量必相等 | |
| B. | 任何条件下,等质量的氧气和臭氧(O3)所含的原子数必相等 | |
| C. | 1L一氧化碳气体一定比1L氧气的质量小 | |
| D. | 等体积、等物质的量浓度的强酸中所含的H+数一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

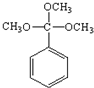 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | CH4 | C2H2 | H2 |
| 燃烧热/kJ/mol | 890.3 | 1299.6 | 285.8 |
| A. | CH4(g)+2O2(g)═CO2 (g)+2 H2O ( l)△H=-890.3 kJ/mol | |
| B. | 质量相等的CH4比C2H2燃烧放出热量少 | |
| C. | 2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| D. | 2CH4(g)═C2H2(g)+3H2(g)△H=-376.4 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=4 | B. | a=b | C. | a<$\frac{b}{2}$ | D. | m<3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
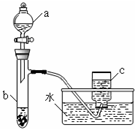 甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.
甲、乙两组同学分别对铜、铁与硝酸的反应进行探究,请你参与并完成对有关问题的解答.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com