
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
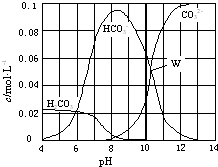 25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1mol Na2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH 的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A、W点所示的溶液中:c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
| B、pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1mol?L-1 |
| C、pH=8的溶液中:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| D、pH=11的溶液中:c(Na+)+c (H+)=c(OH-)+c(Cl-)+c(CO32-)+c(HCO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c?H2? |
| c?CH3OH? |
查看答案和解析>>
科目:高中化学 来源: 题型:
 有可逆反应A(g)+B(s)=2C(g)在不同温度下经过一定时间,混合物中C的百分含量与温度关系如图所示,那么:
有可逆反应A(g)+B(s)=2C(g)在不同温度下经过一定时间,混合物中C的百分含量与温度关系如图所示,那么:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (4)
(4) (5)CH3Cl
(5)CH3Cl  (7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3
(7)CH3COOH (8)CH3CHO (9)CH3COOC2H5 (10)CH3OCH3查看答案和解析>>
科目:高中化学 来源: 题型:
 已知可逆反应aA(g)+bB(g)?cC(g),体系中A、C的浓度随温度的变化曲线如下图1所示,下列说法不正确的是( )
已知可逆反应aA(g)+bB(g)?cC(g),体系中A、C的浓度随温度的变化曲线如下图1所示,下列说法不正确的是( )| A、该反应于T2温度时曾达到过化学平衡 |
| B、该反应正反应是放热反应 |
| C、T1、T3时正反应和逆反应速率相等 |
| D、该反应的速率随温度的变化情况可用上图2表示 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com