
分析 (1)结合m=cVM及稀释前后溶质的物质的量不变,溶液具有均一性分析;
(2)结合稀释前后溶质的物质的量不变及c=$\frac{1000ρw}{M}$计算.
解答 解:配制1mol/L 100mL的CuSO4溶液,所需CuSO4•5H2O固体质量为0.1L×1mol/L×250g/mol=25.0g,若从配制的溶液中取出50mL,则所得溶液的物质的量浓度为 1mol/L,其中c(Cu2+)=1mol/L,n(SO42-)=1mol/L×0.05L=0.05mol,若将取出的50mL溶液加水稀释到200mL,则这时溶液的物质的量浓度为$\frac{1mol/L×0.05L}{0.2L}$=0.25mol/L,故答案为:25.0g;1mol/L;1mol/L;0.05mol;0.25mol/L;
(2)稀释前后溶质的物质的量不变,则0.1L×1.84mol/L=V×$\frac{1000×1.84×98%}{98}$,解得V=0.01L=10mL,故答案为:10.
点评 本题考查物质的量及浓度的计算,为高频考点,把握物质的量为中心的基本计算公式为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:简答题
2011年12月30日中国环境保护部通过了新修订的《环境空气质量标准》,调整了污染物项目及限值,增设了PM2.5平均浓度限值,收紧了NO2等污染物的浓度限值。
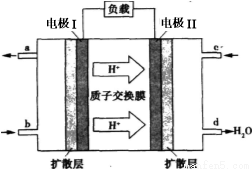
(1)①甲烷是一种清洁燃料,在一定条件下,发生反应:CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
CO(g)+3H2(g) ΔH>0。将1.0 mol CH4和2.0 mol H2O通入反应容器(假设容积为10L),10 min末有0.10 mol CO生成,则10 min内该反应的速率v(H2)= 。②已知甲烷燃料电池的工作原理如右图所示。该电池中甲烷从 进(填“a”、“b”、“c”、“d”),电极Ⅰ是 极,写出该电池负极的电极反应: 。
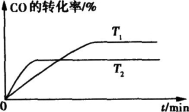
(2)某工厂利用尾气CO制甲醇,在一定压强和固定容积的容器中,通入a molCO与2a mol H2,在催化剂作用下反应:CO(g)+2H2(g)  CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
CH3OH(g),CO的平衡转化率与温度、压强的关系如图所示,则:
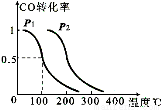
①P1 P2(填“<”、“>”或“=”)。
②下列各项中,不能说明该反应已达到平衡的是 。
a.恒温、恒容条件下,容器内的压强不发生变化
b.一定条件下,CH3OH分解的速率和CH3OH生成的速率相等
c.一定条件下,CO、H2和CH3OH的浓度保持不变
d.一定条件下,单位时间内消耗1 mol CO,同时生成l mol CH3OH
③如下图是该反应在不同温度下CO的转化率随时间变化的曲线。请分别画出在T1 、T2温度下,H2的浓度随时间变化的曲线
(3)某硝酸处理NO2方法是:催化剂存在时用H2将NO2还原为N2。
已知:2H2(g)+O2(g)=2H2O(g) =-483.6kJ/mol
=-483.6kJ/mol
N2(g)+2O2(g)=2NO2(g)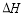 =+67.7kJ/mol
=+67.7kJ/mol
则H2还原NO2生成水蒸气反应的热化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L己烷含有分子的数目为0.1NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | Na2O2与足量H2O反应产生0.1molO2,转移电子的数目为0.2NA | |
| D. | 1mol甲醇中含有C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:选择题
如下图两个电解槽中,A、B、C、D均为石墨电极。如果电解过程中共有0.02mol电子通过,下列叙述中正确的是

A.甲烧杯中A极上最多可析出铜0.64g
B.甲烧杯中B极上电极反应式:4OH--4e- O2↑+2H2O
C.乙烧杯中滴入酚酞试液,D极附近变红
D.乙烧杯中C极上电极反应式:4H++4e- 2H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgCl2溶液中加入Na的小颗粒 | B. | 饱和Ca(OH)2溶液中加入Na的小颗粒 | ||
| C. | KNO3稀溶液中加入Na的小颗粒 | D. | FeCl2溶液中加入Na的小颗粒 |
查看答案和解析>>
科目:高中化学 来源:2017届广东省高三月考二化学试卷(解析版) 题型:选择题
利尿酸在奥运会上被禁用,其结构简式如下图所示。下列叙述正确的是
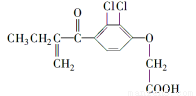
A.利尿酸衍生物利尿酸甲酯的分子式是C14H14Cl2O4
B.利尿酸分子内处于同一平面的原子不超过10个
C.1 mol利尿酸能与7 mol H2发生加成反应
D.利尿酸能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一上期中化学试卷(解析版) 题型:选择题
实验中的下列操作正确的是
A. 用试管取出试剂瓶中的Na2CO3溶液,发现取量过多,为了不浪费,又把过量的试剂倒入试剂瓶中
B. Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水池中,再用水冲入下水道
C. 用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部蒸干
D. 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com