
BaCl2·xH2O是用途广泛的基础化工产品。我国目前主要是用盐酸和硫化钡(含少量Mg2+、Fe3+等)反应生产BaCl2·xH2O,工艺流程如下图所示。
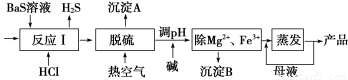
已知:室温时Ksp[Mg(OH)2]=1.8×10-11 , Ksp[Fe(OH)3]=4.0×10-38 ,请回答下列问题:
(1)反应Ⅰ中生成的H2S用足量氨水吸收,一定条件下向所得溶液中通入空气,又可得到单质硫并使吸收液再生,再生反应的化学方程式为_____________________________________。
(2)所得氯化钡粗液中含硫化合物(H2S、HS-等)影响产品质量,可鼓入预热后的空气吹除,预热空气的目的是_______________;沉淀A的主要成分是_______________。
(3)热空气吹除时会有部分HS-转变为S2O O32-,使产品仍达不到纯度要求,可再进行酸化脱硫,酸化脱硫时的离子方程式为______________________________________________________。
(4)室温时,若加碱调溶液pH调至9,则完全沉淀的离子是__________,另一离子浓度为______mol/L (当溶液中离子浓度小于1×10-5 mol/L时认为该离子完全沉淀) 。若向0.1 mol/L FeCl3溶液中加入一定量等浓度的Na2CO3溶液,出现的现象________,发生反应的离子方程式___________________。
(5)将足量的SO2气体通入BaCl2溶液中有无明显现象_____________(填“有”或“无”),向NaOH溶液中通入足量的SO2气体,写出所得溶液离子浓度的大小顺序________________。
科目:高中化学 来源:2015-2016学年宁夏育才中学孔德校区高一下6月考化学卷(解析版) 题型:实验题
已知下列数据:
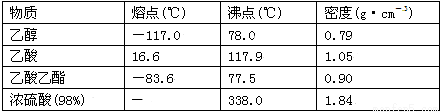
学生在实验室制取乙酸乙酯的主要步骤如下:
①在30 mL的大试管A中按体积比1∶4∶4的比例配制浓硫酸、乙醇和乙酸的混合溶液;
②按下图连接好装置(装置气密性良好),用小火均匀地加热装有混合溶液的大试管5~10 min;

③待试管B收集到一定量的产物后停止加热,撤去试管B并用力振荡,然后静置待分层;
④分离出乙酸乙酯层、洗涤、干燥。
请根据题目要求回答下列问题:
(1)配制该混合溶液的主要操作步骤为________ _______________。
_______________。
(2)上述实验中饱和碳酸钠溶液的作用是(填字母)__________ __________。
A.中和乙酸和乙醇
B.中和乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热操作,其主要理由是________________________。
(4)分离出乙酸乙酯 后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
后,为了干燥乙酸乙酯可选用的干燥剂为(填字母)______。
A.P2O5 B.无水Na2SO4
C.碱石灰 D.NaOH固体
(5)浓硫酸的作用是:① ;② 。
(6)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是防止 。
(7)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。
(8)某同学将收集到的乙酸乙酯滴入饱和NaHCO3溶液中,观察到有少量气泡产生,可得出的结论是 ,该过程中发生反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年宁夏育才中学孔德校区高二下6月考化学卷(解析版) 题型:选择题
有机物3-甲基戊烷的一氯代产物有(不考虑立体异构)( )
A.3种 B.4种 C.5种 D.6种
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三5月高考拉练一模理综化学试卷(解析版) 题型:实验题
草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取COC2O4·2H2O工艺流程如下:
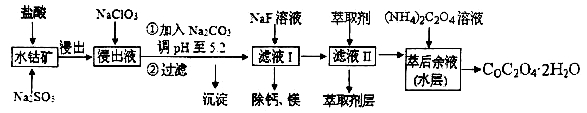
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

(1)浸出过程中加入Na2SO3的目的是_______________。
(2)NaClO3在反应中氯元素被还原为最低价,该反应的离子方程式为 ______________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀。试用离子方程式和必要的文字简述其原理:_____________________________________。
(4)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量NaF后,所得滤液 ______。
______。
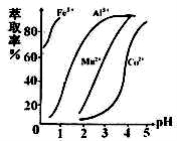
(5)萃取剂对金属离子的萃取率与pH的关系如右图所示,在滤液II中适宜萃取的pH为___左右。
a.1 b.2 c.3 d.4
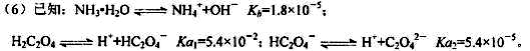
则该流程中所用(NH4)2C2O4溶液的pH_____7(填“>”或“<”或“=”)
(7)CoC2O4·2H2O热分解质量变化过程如右图所示(其中600℃以前是隔绝空气加热,600℃以后是在空气中加热);A、B、C均为纯净物;C点所示产物的化学式是__________
查看答案和解析>>
科目:高中化学 来源:2016届山东省高三5月高考拉练一模理综化学试卷(解析版) 题型:选择题
下列化学用语表示正确的是
A.中子数为20的氯原子:
B.二氧化硅的分子式:SiO2
C.硫化氢的结构式:H—S—H
D.氯化铵的电子式:
查看答案和解析>>
科目:高中化学 来源:2016届宁夏银川二中高三5月适应性训练理综化学试卷(解析版) 题型:选择题
X、Y、Z、W是原子序数依次增大的四种短周期元素,已知X、Z,Y、W分别位于同一主族,X与Z形成的离子化合物能与X、Y形成的常见液态共价化合物反应生成X2单质,Y、W两元素可形成两种常见的化合物,以下说法正确的是
A.X、Y、Z、W四种元素形成的化合物,其水溶液一定显强酸性
B.Y、W的氢化物的稳定性后者强于前者
C.X、Y、Z、W形成的简单离子半径大小依次增大
D.Z的单质可与X、Y形成的共价化合物反应生成X2单质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末化学试卷(解析版) 题型:实验题
海洋资源的利用具有广阔前景.
(1)如图是从海水中提取镁的简单流程.
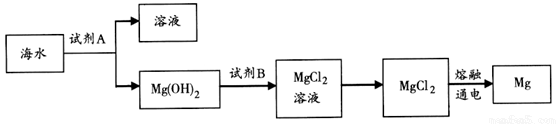
①工业上常用于沉淀Mg2+的试剂A是________,Mg(OH)2转化为MgCl2的离子方程式是_______.
②由无水MgCl2制取Mg的化学方程式是________.
(2)海带灰中富含以I﹣形式存在的碘元素.实验室提取I2的途径如下所示:
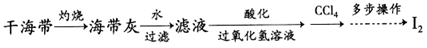
①灼烧海带至灰烬时所用的主要仪器名称是________.
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式________.
③反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:

甲、乙、丙3步实验操作中,不正确的是________(填“甲”、“乙”或“丙”).
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省冀州市高一下期末化学试卷(解析版) 题型:选择题
镁燃料电池具有比能量高、使用方便、原材料来源丰富、成本低等特点。一般研究的镁燃料电池可分为镁空气燃料电池、镁海水燃料电池、镁过氧化氢燃料电池和镁次氯酸盐燃料电池。其中,镁次氯酸盐燃料电池的工作原理如图所示,下列有关说法不正确的是( )
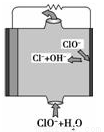
A.镁燃料电池中镁均为负极,发生氧化反应
B.镁次氯酸盐燃料电池的总反应式为Mg+ClO-+H2O=Mg(OH)2+Cl-
C.镁过氧化氢燃料电池,酸性电解质中正极反应式为H2O2+2H++2e-=2H2O
D.镁次氯酸盐燃料电池放电过程中OH-移向正极
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下第二次段考化学卷(解析版) 题型:实验题
某化学课外小组通过实验探究化学反应速率和化学反应限度。
(1)实验一:探究温度和浓度对反应速率的影响
方案:在酸性溶液中,碘酸钾( KIO3)和亚硫酸钠可发生反应生成碘(2IO3﹣+5SO32﹣+2H+═I2+5SO42﹣+H2O),生成的碘可用淀粉溶液检验,根据出现蓝色所需的 时间来衡量该反应的速率。
实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
① | 5 | 5 | V1 | 0 | |
② | 5 | 5 | 40 | 25 | |
③ | 5 | V2 | 35 | 25 |
则V1= mL,V2= mL.
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。
实验步骤:
ⅰ.向5mL0.1mol/L KI溶液中滴加5~6滴0.1mol/L FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①写出KI和FeCl3反应的离子方程式: 。
②步骤ⅲ中,试剂X是 。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCI、I2和FeCl2的反应存在一定的限度,该实验现象是:
ⅱ中 。
ⅲ中 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com