
【题目】CH4—CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4—CO2催化重整反应为CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol-1
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol-1
C(s)+![]() O2(g)=CO(g)ΔH=-111kJ·mol-1
O2(g)=CO(g)ΔH=-111kJ·mol-1
该催化重整反应的ΔH=__kJ·mol-1。有利于提高CH4平衡转化率的条件是___(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2L的容器中加入2molCH4、1molCO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为___mol2·L-2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
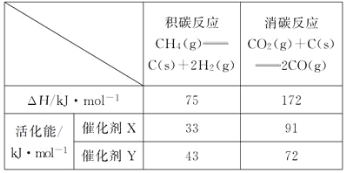
①由上表判断,催化剂X__Y(填“优于”或“劣于”),理由是___。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是__(填标号)。
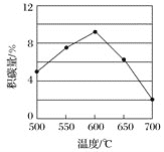
A.K积、K消均增加
B.v积减小、v消增加
C.K积减小、K消增加
D.v消增加的倍数比v积增加的倍数大
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为___。

【答案】247 A ![]() 劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD pc(CO2)>pb(CO2)>pa(CO2)
劣于 相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大 AD pc(CO2)>pb(CO2)>pa(CO2)
【解析】
(1)将题给三个反应依次编号为①、②、③:
C(s)+2H2(g)=CH4(g)ΔH=-75kJ·mol-1①
C(s)+O2(g)=CO2(g)ΔH=-394kJ·mol-1②
C(s)+![]() O2(g)=CO(g)ΔH=-111kJ·mol-1③
O2(g)=CO(g)ΔH=-111kJ·mol-1③
根据盖斯定律,由③×2-①-②可得
CH4(g)+CO2(g)=2CO(g)+2H2(g)ΔH=247kJ·mol-1;根据平衡移动的影响因素,该反应的正反应是一个吸热、气体体积增大的反应,所以高温低压有利于反应正向移动;该反应三段式为:

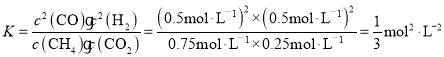 ;
;
(2)①积碳反应中,由于催化剂X的活化能比催化剂Y的活化能要小,所以催化剂X更有利于积碳反应的进行;而消碳反应中,催化剂X的活化能大于催化剂Y,所以催化剂Y更有利于消碳反应的进行,综合分析,催化剂X劣于催化剂Y;由表格可知积碳反应、消碳反应都是吸热反应,温度升高,平衡右移,K积、K消均增加,反应速率均增大,从图像上可知,随着温度的升高,催化剂表面的积碳量是减小的,所以v消增加的倍数要比v积增加的倍数大;
②由速率方程表达式v=k·p(CH4)·[p(CO2)]-0.5可知,v与p(CO2)成反比例关系,p(CO2)越大,反应速率越小,所以pc(CO2)>pb(CO2)>pa(CO2)。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】材料是经济和生态文明建设的重要物质基础。
①生产硅酸盐水泥和普通玻璃都需用到的共同原料是___。
②橡胶是制造轮胎的重要原料,橡胶属于___(填字母)。
A.金属材料 B.无机非金属材料 C.有机高分子材料
③钢铁制品在潮湿的空气中能发生__腐蚀.发生该腐蚀时的负极反应式为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物N广泛应用于高分子材料、香料、医药、农药、防腐剂等行业,可通过如图转化得到(用键线式表示该转化)。下列说法错误的是( )
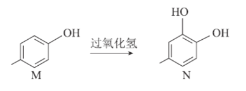
A.M→N发生氧化反应
B.M和N互为同系物
C.苯环上所连基团的种类和数目与N相同的结构还有5种(不考虑立体异构)
D.N中最多可能有15个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸俗称草酸,为二元酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数K1=5.0×10-2,K2=5.4×10-5;碳酸的电离平衡常数K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式:________________________________。
(2)25℃,物质的量浓度都为0.1 mol/L的Na2C2O4溶液的pH比Na2CO3溶液pH______________________(填“大”“小”或“相等”)。
(3)常温下将0.2 mol/L的KOH溶液10 mL与0.2 mol/L的草酸溶液10 mL混合,若混合溶液显酸性,则该溶液中所有离子浓度由大到小的顺序:____________________。
(4)25℃时向20 mL碳酸钙的饱和溶液中逐滴加入1.0×10-3mol/L的草酸钾溶液20 mL,能否产生沉淀?________________(填“能”或“否”)。
(5)除去锅炉水垢中的CaSO4可先用碳酸钠溶液处理,而后用盐酸溶解,其反应的离子方程式:______________________________;________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-)
C.常温下,pH=6的NaHSO3溶液中:c(SO32-)﹣c(H2SO3)=9.9×10-7molL-1
D.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用下列装置进行乙醇催化氧化的实验。

(1)实验过程中铜网出现红色和黑色交替的现象,请写出相应的化学反应方程式:______________________________________________。
在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是________反应。
(2)甲和乙两个水浴作用不相同。
甲的作用是__________________________;乙的作用是__________________________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是________________。集气瓶中收集到的气体的主要成分是__________________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有__________。要除去该物质,可先在混合液中加入________________(填写字母)。
a.氯化钠溶液 b.苯
c.碳酸氢钠溶液 d.四氯化碳
然后,再通过________________(填实验操作名称)即可除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
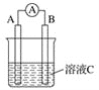
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:
(1)2A(g) ![]() 2B(g)+C(g); (2)A(g)
2B(g)+C(g); (2)A(g) ![]() C(g)+D(g)。
C(g)+D(g)。
当达到平衡时,测得c(A)=2.5 mol·L-1(表示该物质浓度,下同),c(C)=2.0 mol·L-1。则下列说法中正确的是( )
A.达到平衡时A的总转化率为40%B.达到平衡时c(B)为1.0 mol·L-1
C.达到平衡时c(B)=2c(D)D.达到平衡时c(D)=2c(B)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com