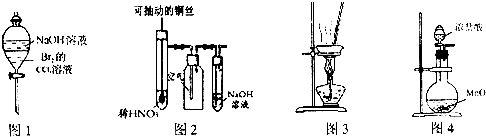
���㣺��ѧ����ʽ���йؼ���,þ��������Ҫ������
ר�⣺
��������1���ٶ������̡����塢ˮ�����ӷ���ʽ��Ӧ������ѧʽ��
�ڸ���ClԪ�صĻ��ϼ۱仯��ԭ���غ��֪����������HCl�����ʵ����������������ʵ�����2����
�۸���c=
������Ũ��������ʵ���Ũ�ȣ�
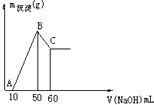
��2������ͼ��֪���Ӽ���10m����������Һ��ʼ������������������������ҺΪ50mLʱ�����������ʱΪMg��OH��
2��Al��OH��
3���ý�������������40mL�����������غ��֪3n[Al��OH��
3]+2n[Mg��OH��
2]=n��NaOH��=��0.05L-0.01L����1mol/L=0.04mol���Ӽ�������������Һ50mL��60mL�ܽ������������ýη�����ӦAl��OH��
3+NaOH=NaAlO
2+2H
2O������n[Al��OH��
3]=��0.06L-0.05L����1mol/L=0.01mol��������ʽ����n[Mg��OH��
2]����Ԫ���غ��֪n��Mg��=n[Mg��OH��
2]��������m=nM����Mg��Al��������
�ڼ�������������ҺΪ60mLʱ�����������ʱΪMg��OH��
2��Al��OH��
3����ҺΪ�Ȼ�����Һ��������Ԫ���غ��ʱ��Һ��n��NaCl��=n��NaOH�����ݴ˼����n��HCl����������c=
������������ʵ���Ũ�ȣ�
���
�⣺��1���ٷ�Ӧ�Ļ�ѧ����ʽΪMnO
2+4HCl��Ũ��
MnCl
2+C1
2��+2H
2O����дΪ���ӷ�Ӧʱ�������̡�������ˮ�����ӷ���ʽ��Ӧ������ѧʽ��
�����ӷ���ʽΪMnO
2+4H
++2Cl
-Cl
2��+Mn
2++2H
2O���ʴ�Ϊ��MnO
2+4H
++2Cl
-Cl
2��+Mn
2++2H
2O��
�������ڱ�״���µ����Ϊ22.4L��n��Cl
2��=
=1mol����MnO
2+4H
++2Cl
-Cl
2��+Mn
2++2H
2O��֪��4molHCl��Ӧʱֻ��2mol����ԭ����������
��������HCl�����ʵ���Ϊ1mol��2=2mol���ʴ�Ϊ��2mol��
����c=
��֪��c=
=11.9 mol?L
-1���ʴ�Ϊ��11.9��
��2������ͼ��֪���Ӽ���10m����������Һ��ʼ������������������������ҺΪ50mLʱ�����������ʱΪMg��OH��
2��Al��OH��
3���ý�������������40mL�����������غ��֪3n[Al��OH��
3]+2n[Mg��OH��
2]=n��NaOH��=��0.05L-0.01L����1mol/L=0.04mol���Ӽ�������������Һ50mL��60mL�ܽ������������ýη�����ӦAl��OH��
3+NaOH=NaAlO
2+2H
2O������n[Al��OH��
3]=��0.06L-0.05L����1mol/L=0.01mol����3��0.01mol+2n[Mg��OH��
2]=0.04mol�����n[Mg��OH��
2]=0.005mol����Ԫ���غ��֪n��Mg��=n[Mg��OH��
2]=0.005mol����m��Mg��=0.005mol��24g?mol
-1=0.12g��m��Al��=0.01mol��27g?mol
-1=0.27g��
�ʴ�Ϊ��0.12��
�ڼ�������������ҺΪ50mLʱ�����������ʱΪMg��OH��
2��Al��OH��
3����ҺΪ�Ȼ�����Һ��������Ԫ���غ��ʱ��Һ��n��NaCl��=n��NaOH��=0.05L��1mol/L=0.05mol��������Ԫ���غ�n��HCl��=0.05mol������������ʵ���Ũ��Ϊ
=0.5mol/L���ʴ�Ϊ��0.5��
���������⿼�黯ѧ��Ӧ���йؼ��㣬Ϊ��Ƶ���㣬���շ����ķ�Ӧ����Ӧ�����ʵ�����ϵ��ͼ��Ӧ�Ķ�Ӧ��ϵ���ǽ��Ĺؼ������ط�������������Ŀ��飬��Ŀ�Ѷ��еȣ�



 ��У����ϵ�д�
��У����ϵ�д�