
| A. | 铝片跟氢氧化钠溶液反应:Al+2OH-═AlO2-+H2↑ | |
| B. | 硫酸镁溶液跟氢氧化钡溶液反应:SO42-+Ba2+═BaSO4↓ | |
| C. | 硫酸氢钠与氢氧化钠溶液反应:H++OH-═H2O | |
| D. | 铜片跟稀硝酸反应:Cu+NO3-+4H+═Cu2++NO↑+2H2O |
分析 A.漏写氧化剂水;
B.漏写生成氢氧化镁的离子反应;
C.反应生成硫酸钠和水;
D.反应硝酸铜、NO、水.
解答 解:A.铝片跟氢氧化钠溶液反应的离子反应为2Al+2H2O+2OH-═2AlO2-+3H2↑,故A错误;
B.硫酸镁溶液跟氢氧化钡溶液反应的离子反应为2OH-+Cu2++SO42-+Ba2+═BaSO4↓+Cu(OH)2↓,故B错误;
C.硫酸氢钠与氢氧化钠溶液反应的离子反应为H++OH-═H2O,故C正确;
D.铜片跟稀硝酸反应的离子反应为3Cu+2NO3-+8H+═3Cu2++2NO↑+4H2O,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:填空题
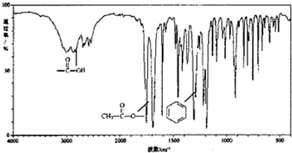 有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图:
有机物X (C9H804)是一种应用最早、最广的药物之一,也是重要的合成中间体.有机物X的仪器分析如图: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3能与酸反应,但不能与碱反应 | |
| B. | FeO在空气中受热,会被氧化为Fe3O4 | |
| C. | Na2O2既有氧化性又有还原性,故Na2O2属于两性氧化物 | |
| D. | Na2O和Na2O2中阴、阳离子个数之比分别为1:2 和1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水泥、陶瓷、玻璃是三大重要的硅酸盐产品 | |
| B. | 水玻璃是建筑行业经常使用的黏合剂 | |
| C. | 高纯度的硅被用于制作光导纤维 | |
| D. | 水晶、石英的主要成分是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 六水氯化钙可用作食品干燥剂 | |
| B. | 生石灰作干燥剂是物理变化 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入大量食品添加剂 | |
| D. | “血液透析”利用了胶的性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 水/硝酸钙 | 0.8:1 | 0.9:1 | 0.95:1 | 1:1 | 1.05:1 | 1.1:1 | 1.15:1 |
| 浸出率/% | 83.1 | 94.5 | 98.2 | 99.1 | 99.5 | 99.6 | 99.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com