
【题目】某工厂的固体废渣中主要含Cu和CuO,还含有少量Cu2O和SiO2等。利用该固体废渣制取Cu (NO3)2的部分工艺流程如图所示:
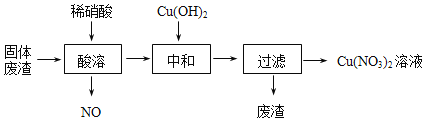
(1)Cu2O与稀硝酸反应的离子方程式为 。
(2)酸溶时,反应温度不宜超过70℃,其主要原因是 ,若保持反应温度为70℃,欲加快反应速率可采取的措施为 (写出一种即可)。
(3)过滤后所得废渣的主要成分的化学式为 。
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,该反应的化学方程式为 ,由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、 、过滤、冰水洗涤、 。
【答案】(1)3Cu2O +14H++ 2NO3-= 6Cu2++2NO↑+7H2O
(2)防止温度过高HNO3分解(或者挥发); 搅拌、将固体废渣粉碎、适当提高硝酸的浓度
(3)SiO2
(4)2 Cu(NO3)2 ![]() 2 CuO+4 NO2↑+ O2 冷却结晶 低温烘干
2 CuO+4 NO2↑+ O2 冷却结晶 低温烘干
【解析】
试题分析:(1)Cu2O中铜元素的化合价为+1价,具有还原性,能与硝酸发生氧化还原反应生成硝酸铜、NO和水,根据得失电子守恒、电荷守恒和原子守恒配平,反应的离子方程式为3Cu2O+14H ++2NO3-= 6Cu2++2NO↑+7H2O。
(2)为了防止温度过高HNO3分解,所以酸溶时,反应温度不宜超过70℃;根据影响化学反应速率的因素,若保持反应温度为70℃,欲加快反应速率可采取的措施为搅拌、将固体废渣粉碎、适当提高硝酸的浓度。
(3)Cu、CuO、Cu2O和SiO2这四种物质,只有SiO2和硝酸不反应,所以过滤后所得废渣的主要成分是二氧化硅,化学式为SiO2。
(4)Cu(NO3)2晶体受热易分解成CuO,同时产生NO2和O2,则该反应的化学方程式为2 Cu(NO3)2![]() 2 CuO+4NO2↑+ O2;根据硝酸铜的溶解性特征及受热易分解的性质,由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、冰水洗涤、低温烘干。
2 CuO+4NO2↑+ O2;根据硝酸铜的溶解性特征及受热易分解的性质,由Cu(NO3)2溶液制Cu(NO3)2晶体的操作方法是:蒸发浓缩、冷却结晶、过滤、冰水洗涤、低温烘干。


科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列叙述不正确的是( )
A.钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA
B.1 mol Cu和足量热浓硫酸反应可生成NA 个SO3分子
C.3 mol单质Fe完全转变为Fe3O4,失去8NA电子
D.1mol铁和氯气完全反应时转移的电子数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届江苏苏中三市二调】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知Fe3+在pH=5时沉淀完全)。其中分析错误的是
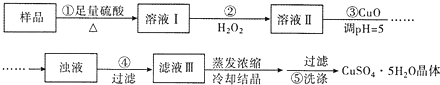
A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B.步骤②可用氯水、硝酸等强氧化剂代替H2O2
C.步骤③用CuCO3代替CuO也可调节溶液的pH
D.步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于水的电离平衡叙述不正确的是( )
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中加入金属钠,c(H+)减小
D.向水中通入氯化氢气体,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类、油脂、蛋白质的说法正确的是
A.蔗糖在人体内水解产物只有葡萄糖
B.油脂水解可得到氨基酸和甘油
C.淀粉和纤维素水解最终产物都是葡萄糖
D.鉴别部分蛋白质可利用浓硫酸与蛋白质的颜色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,下列溶液的pH值最小的是
A. 0.01mol·L-1HCl
B. pH=2的H2SO4溶液
C. c(OH)=10-13 mol·L-1
D. pH=1溶液加水稀释1倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象描述错误的是( )
A.往稀硫酸中滴加酚酞试液,溶液变红色
B.往淀粉溶液中滴加碘水,溶液显蓝色
C.H2在C12中燃烧发出苍白色火焰
D.将SO2 通入品红溶液,溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A.2.4g镁在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.8NA
B.标准状况下,5.6L二氧化碳气体中含有的氧原子数为0.5NA
C.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
D.0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com