
【题目】丙烯是一种重要的化工原料.2000年以来,我国丙烯的使用量已超过乙烯,且已知保持增长趋势.现以丙烯为原料合成环酯G和高聚物(C3H4O2)n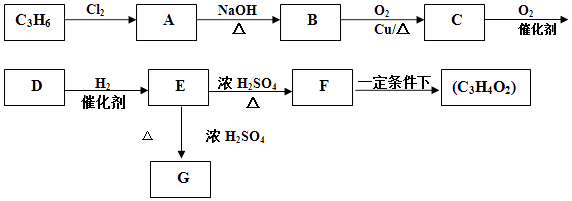
已知:F的分子式为C3H4O2;有机物G的分子式为C6H8O4 , 含有一个六元环.
(1)E中含氧官能团的名称是 .
(2)B→C的反应类型是;E→F的反应类型是 .
(3)有机物C的结构简式为 .
(4)由F合成高聚物(C3H4O2)n的化学方程式为;由E合成G的化学方程式为 .
科目:高中化学 来源: 题型:
【题目】下列图中的实验方案,能达到实验目的是( )
A | B | C | D | |
实验方案 |
|
|
|
|
实验目的 | 探究温度对平衡的影响 | 比较HCl、H2CO2和 | 除去CO2气体中混有的SO2 | 验证FeCl3对H2O2分解反应有催化作用 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮酸是医药合成中的一种重要中间体,某研究小组对苯乙酮酸展开如下设计研究:

已知:I. ![]() II.
II. ![]()
请回答:
(1)下列说法正确的是_____________;
A.反应①②④都是取代反应 B.化合物C能发生消去反应
C.化合物D中含有两种官能团 D.化合物E的分子式为C17H25NO3
(2)反应④D→E的化学方程式是___________________________________。
(3)化合物M的结构简式是___________________________。
(4)写出同时符合下列条件的化合物 的所有同分异构体的结构简式____________。
的所有同分异构体的结构简式____________。
①能发生银镜反应
②1H-NMR谱显示分子中有三种不同化学环境的氢原子。
(5)采用甲苯为原料制备苯乙酮酸(![]() ),请设计该合成路线(用流程图表示,无机试剂任选)_____。
),请设计该合成路线(用流程图表示,无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向恒温、恒容(2L)的密闭容器中充入2 mol SO2和一定量的O2,发生反应:2SO2(g) + O2(g)![]() 2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
2SO3(g) ; △H= -197.74 kJ·mol-1,4min后达到平衡,这时c(SO2)=0.2mol·L-1,且SO2和O2的转化率相等。下列说法中,不正确的是
A.2min时,c(SO2)=0.6mol·L-1
B.用O2表示4min内的反应速率为0.1mol·(L·min)-1
C.再向容器中充入1mol SO3,达到新平衡,n(SO2):n(O2)=2:1
D.4min后,若升高温度,平衡向逆方向移动,平衡常数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于资源综合利用和环境保护的化学方程式与工业生产实际不相符的是
A. 海水提溴时用SO2吸收Br2蒸气:SO2 + Br2 + 2H2O=H2SO4 + 2HBr
B. 将煤气化为可燃性气体:C(s) + H2O(g)![]() CO(g) + H2(g)
CO(g) + H2(g)
C. 用电解法从海水中提取镁:2MgO(熔融)![]() 2Mg + O2↑
2Mg + O2↑
D. 燃煤时加入CaCO3脱硫:2CaCO3 + 2SO2 + O2![]() 2CaSO4 + 2CO2
2CaSO4 + 2CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6molA气体和5molB气体混合放入4L密闭容器中,在一定条件下发生反应:3A (g)+B(g)2C(g)+xD(g),经5min达到平衡,此时生成C为2mol,测定D的平均反应速率为0.1mol/(Lmin),下列说法错误的是( )
A.x=2
B.B的转化率为20%
C.平衡时A的浓度为0.75mol/L
D.恒温达平衡时容器内的压强为开始时的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X元素的阳离子与Y的阴离子具有相同的核外电子排布,则下列比较中正确的是( )
A.原子序数: X<YB.原子半径:X<Y
C.离子半径:X<Y D.原子最外层电子数:X<Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com