
����Ŀ����ⷨ��ȡ�й㷺��;��Na2FeO4��ͬʱ�������������ԭ����ͼ1��ʾ��c( Na2FeO4)���ʼc(NaOH)�ı仯��ͼ2��
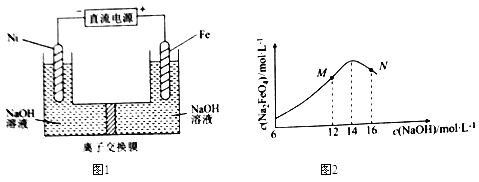
��֪��FeO42-Ϊ�Ϻ�ɫ��Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ����Һ��OH-Ũ�ȹ��ߣ����缫����������ɫ���ʡ�����˵����������� ��
A���Ʊ�Na2FeO4�ĵ缫��ӦΪFe-6e-+8OH-=FeO42-+4H2O
B���������У��뽫�������������弰ʱ�ų�
C��MN������c(Na2FeO4)�������ֵ��ԭ��ͬ����M�����Fe(OH)3����
D��ͼ1�е����ӽ���ĤΪ�����ӽ���Ĥ���������У�����������pH������
���𰸡�C
��������
���������A�������������缫�����ݲ����������ӷŵ��������������缫����������Ӧ���缫��ӦʽΪFe-6e-+8OH-=FeO42-+4H2O��A��ȷ��B���������л�ԭ�ԣ���������Na2FeO4ֻ��ǿ�����������ȶ����ױ�H2��ԭ���������У��뽫�������������弰ʱ�ų�����ֹNa2FeO4��H2��Ӧʹ���ʽ��ͣ�B��ȷ��C����������Na2FeO4ֻ��ǿ�����������ȶ�����M�㣬c(OH-)�ͣ�Na2FeO4�ȶ��Բ�ҷ�Ӧ������N�㣺c(OH-)���ߣ����缫���������������ɣ�ʹNa2FeO4���ʽ��ͣ�C����D��������Ҫ���������������ͼ1�е����ӽ���ĤΪ�����ӽ���Ĥ���������У����������������ŵ磬�ƻ�ˮ�ĵ���ƽ�⣬��������������pH������D��ȷ����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʵ�����У�ͨ���Ǽ��Ⱦƾ���Ũ����Ļ�����170��ʱ�Ƶ���ϩ���������Ӧ�У�Ũ�������������ˮ�������á�
I���ο��������ϣ������ѧ֪ʶ���ش��������⡣
����������˵���в���ȷ����_____������ţ�
�ᣮһ����ϩ��CH2��CHCl��������ԭ����ͬһƽ����
�⣮��ϩ�����е�̼̼˫����������ͬ��̼̼˫��
�㣮��;����ˮ��ʱ�����ø����������ˮ���ͷŵ���ϩ���Ա���ˮ������
�䣮��ȥ�����е���ϩ������ѡ�����Ը��������Һ
��2��ʵ������ȡ��ϩ��Ӧ�Ļ�ѧ����ʽ��_________________________��
��3��ʵ������ȡ����ϩ�л���SO�����������ʡ������Լ��У������ڼ�����ϩ�л��е�SO2����_____��
�ᣮ��ˮ b�����Ը��������Һ c��Ʒ����Һ
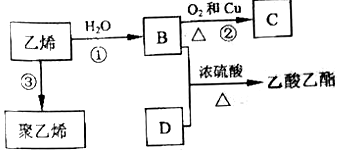
����֪��ϩ�ܷ�������ת����
 �����
�����
��1��B�������������ŵ�������_________________________��
��2����Ӧ�ڵĻ�ѧ����ʽ��________________________��
��3��B��D�ķ�Ӧװ����ͼ��ʾ��
д��ʵ������ȡ���������Ļ�ѧ����ʽ��_______________����Ӧ������ _____________��
��4���Թ�b��ʢ�ŵ��Լ���___________��Һ���Թܣ���ܵ��¶˲��ܲ���Һ�����£���Ŀ����_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����칬���š���2016��9��15�շ���ɹ������ҹ��Ƽ���չ�ļ������֡�������Դ�Ͳ��ϣ�����˵���������
A�����ά����Ϣ��ҵ���й㷺��Ӧ�ã�������ά����Ҫ�����Ƕ�������
B��ú�ĸ���������Һ�������ڻ�ѧ�仯
C����������������Դʱ�������ܡ�̫���ܺ����ܵȺܿ��ܳ�Ϊ��Ҫ��Դ
D�����ϲ��������л����Ӳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����þ��MgSO47H2O����ӡȾ����ֽ��ҽҩ�ȹ�ҵ�϶��й㷺��Ӧ�ã����û�����������ɰ�ķ�������þ�����ȡ��ˮ����þ����þ�����Ҫ�ɷ���MgCO3���������������ʣ�MgO��SiO2��Fe2O3��FeO��CaO��Al2O3��MnO�ȣ���
��1 ����������������������ʽ��ȫ����ʱ��Һ��pH
������ | Al��OH��3 | Fe��OH��3 | Fe��OH��2 | Mn��OH��2 | Mg��OH��2 | ||||||
pHֵ | 5.2 | 3.2 | 9.7 | 10.4 | 11.2 | ||||||
��2 �����ε��ܽ�ȣ���λΪg/100gˮ��
�¶�/�� | 10 | 30 | 40 | 50 | 60 | ||||||||||||
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 | ||||||||||||
MgSO47H2O | 30.9 | 35.5 | 40.8 | 45.6 | / | ||||||||||||
��þ����ȡ��ˮ����þ�Ĺ����������£�
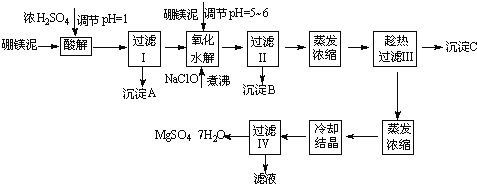
������������ͼ���ο�����pH���ݺ��ܽ�����ݣ��Իش��������⣺
��1������I����Һ�м�����þ�࣬������Һ��pH=5��6���ټ���NaClO��Һ������У�����Һ�е�Mn2+������MnO2����Ӧ�����ӷ�Ӧ����ʽΪ ��������е���ҪĿ���� ��
��2������B�г�MnO2��SiO2����� ���ѧʽ����������
��3��������ˢ�����Һ���Ƿ���Fe3+��ʵ�鷽���� ��
��4������C�Ļ�ѧʽ�� �����ˢ�����ȹ��˵������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ���ǣ� ��
A��NH3��Һ���������������
B��NH4Cl�к���������I2��ͨ�����ȵķ�����ȥ
C����������ֽ⣬������氱̬����ʱҪ�ܷⱣ�棬����������ͨ�紦
D��Ũ�����豣������ɫƿ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijС������H2C2O4��Һ������KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱ���ȷֱ���ȡ������Һ��Ȼ�����Թ���Ѹ����Ͼ��ȣ���ʼ��ʱ��ͨ���ⶨ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�����
��� | H2C2O4��Һ | ����KMnO4��Һ | |||
Ũ��/mol��L��1 | ���/mL | Ũ��/mol��L��1 | ���/mL | �¶ȡ� | |
�� | 0.10 | 2.0 | 0.010 | 4.0 | 20 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 20 |
�� | 0.20 | 2.0 | 0.010 | 4.0 | 40 |
��1��д���÷�Ӧ�Ļ�ѧ����ʽ ��
��2��̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������____________��
��3��ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ40s�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��_____________mol��L��1��min��1��
��4�� �����������������䣬��ͼ�������߷ֱ��ʾ20����40��ʱc(MnO)����Ӧʱ��t�ı仯���ߡ�40��ʱc(MnO)��t�ı仯����Ϊ ������дA��B��
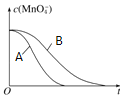
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯������������������������Ҫ����;����֪��Sn���۵�Ϊ231����Sn2+��ˮ�⡢�ױ�������SnCl4����ˮ�⡢�۵�Ϊ-33 �����е�Ϊ114 �����밴Ҫ��ش�����������⣺
��1��Ԫ������ͬ����̼����������3������ԭ������Ϊ_______________��
��2�����������������������۴��Ȳⶨ����ȡ1.19 g��������ϡ�����У����ʲ����뷴Ӧ����ʹSn��ȫת��ΪSn2+�������������Fe2(SO4)3������0.1000 mol/L K2Cr2O7��Һ�ζ���������Cr��+3�ۣ�������20.00 mL���������м���Fe2(SO4)3��������__________________����������Ʒ��������������_____________��
��3�����ڶ�����ҵ����������(SnSO4)���Ʊ�·�����£�

������������Sn�۵����ã� __________________��������ҺpH��
�����������������IJ�������Ϊ________________��д���ù����õ���һ�ֲ������������ƣ�_______________��
������������SnO�����ӷ���ʽ��__________________��
����������������Ϊ _____________��____________�����ˡ�ϴ�ӡ����¸��
��4��SnCl4����������ˮ����Ũ��״�������������Ļ�����䷴Ӧ�Ļ�ѧ����ʽΪ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����X����ͨ��BaCl2��Һ��δ���������ɣ�Ȼ��ͨ��Y���壬�г������ɣ�X��Y�������ǣ� ��
A��SO2 �� H2S B��NH3�� CO2 C��Cl2 �� CO2 D��SO2 ��Cl2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������ȡ������ʧ��ҩ�����������м��塣
I����֪����������ṹ��ͼ��ʾ��

��1�����������������������Ϊ ��
��2�������й����������������������ȷ���� ������ĸ����
A��������ˮ
B�����ܷ�����ȥ��Ӧ
C��������ˮ��Ӧ
D����FeCl3��Һ���Ժ�ɫ
E������̼��������Һ��Ӧ����������̼
��3��1Ħ�������������������NaOH��Һ��Ӧ���������NaOH mol ��
II����֪X�����������л����������ת����ϵ���Ҳ��A�к���������

˵�������Գ�ϩ����±���ⷢ���ӳɷ�Ӧ��Ҫ������ѭ���¹������Ϲ���ͨ������£���ӵ������IJ�����̼ԭ��һ�෴���Ϲ����ڹ������������£�±ԭ���ӵ������IJ�����̼ԭ��һ��
�ش��������⣺
��4��X�Ľṹ��ʽΪ ��
��5��B��ϵͳ������___________________________ ��
��6��д��C����D�Ļ�ѧ����ʽ ���ýṹ��ʽ��ʾ����
��7��д������������������������һ��ͬ���칹��Ľṹ��ʽ ��
���ܷ���������Ӧ
����ʹFeCl3��Һ��ɫ
������
�������ϵ�һ�ȴ���ֻ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com