
| A、已知:N2(g)+2O2(g)=2NO2(g)△H=+68kJ?mol-12C(s)+O2(g)=2CO(g)△H=-221kJ?mol-1C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1则4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=+1200kJ?mol-1 | ||||||||||||
| B、由H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ?mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ | ||||||||||||
C、通常人们把拆开1 mol气态物质中某种共价键需要吸收的能量看成该共价键的键能
| ||||||||||||
| D、NH4HCO3(s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ?mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
| A、浓H2SO4有氧化性,稀H2SO4无氧化性 |
| B、由于浓H2SO4具有吸水性,所以通常可用做干燥剂 |
| C、在通常情况下可以用铁制容器或铝制容器存放浓硫酸 |
| D、浓H2SO4不慎沾在皮肤上应立即用大量水冲洗,然后涂上NaHCO3溶液(3%-5%) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、5.3g | B、3.1g |
| C、4.2g | D、10.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
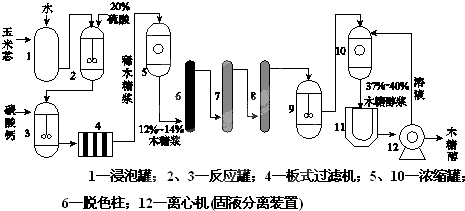

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.28L |
| B、0.56L |
| C、1.12L |
| D、2.24L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、32.8g |
| B、46.8g |
| C、53.6g |
| D、63.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D | |
| 被提纯物 | 酒精 | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
| 除杂试剂 | 生石灰 | 氢氧化钠溶液 | 酸性高锰酸钾溶液 | KI溶液 |
| 分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com