


 .设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
.设计实验证明a中甲醛中的碳元素未被氧化成+4价.写出实验操作、现象、结论取少量a中反应后的清液,滴入过量稀硫酸,未见气泡产生,说明甲醛中的碳元素未被氧化成+4价.
分析 (1)①根据仪器构造可知为冷凝管;
②甲醛具有还原性,和新制氢氧化铜加热反应生成氧化亚铜红色沉淀;
(2)为确认产生的气体为CO、H2中的一种或两种,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.据此设计实验验证;
(4)①锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子;
②反应现象和元素守恒得到固体物质组成为氧化亚铜和铜,将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近说明浓度相同.
解答 解:(1)①仪器b为球形冷凝管;
故答案为:球形冷凝管;
②能说明甲醛具有还原性的实验现象是和新制氢氧化铜加热反应生成氧化亚铜红色沉淀,即a中出现砖红色物质;
故答案为:a中出现砖红色物质;
(2)为确认产生的气体为CO、H2中的一种或两种,装置A连接装置B除去甲醛,防止干扰后续实验验证,利用装置E吸收水蒸气,通过装置F中氧化铜加热反应,利用装置D中无水硫酸铜检验是否生成水蒸气,装置C中澄清石灰水检验是否生成二氧化碳验证气体中是否含一氧化碳,通过装置G收集剩余气体,依次连接的合理顺序为ABEFDCG,装置B的作用是吸收甲醛蒸气,防止其干扰后续检验;F中黑色固体变红色,D中固体变蓝色说明有氢气生成;
故答案为:E→F→D→C;吸收甲醛蒸气,防止其干扰后续检验;F中黑色固体变红色,D中固体变蓝色;
(3)甲醛被氧化为甲酸,甲酸被氧化为碳酸,若碱溶液中甲醛被氧化生成碳酸盐,加入浓盐酸会生成二氧化碳气体.设计实验证明a中甲醛的碳元素未被氧化成+4价的方法为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;
故答案为:取少量a中反应后的清液,滴入过量的浓盐酸,未见气泡产生,说明甲醛的碳元素未被氧化成+4价;
(4)①锥形瓶ⅱ中固体完全溶解得深蓝色溶液是铜、氧气和一水合氨溶液反应生成深蓝色络离子,反应的离子方程式为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
故答案为:2Cu+8NH3•H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O;
②将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近.由此可知固体产物的组成及物质的量之比约为n(Cu2O):n(Cu)=1:200;
故答案为:n(Cu2O):n(Cu)=1:200.
点评 本题考查了物质组成的实验探究、物质性质、反应现象、实验关系分析判断,掌握基础是解题关键,题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
 ,下列命名正确的是( )
,下列命名正确的是( )| A. | 2,3,4-三甲基己烷 | B. | 2,3-二甲基-4-乙基戊烷 | ||
| C. | 4-乙基-2,3-二甲基戊烷 | D. | 2-乙基-3,4-二甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体中每个C原子连接4个N原子,而每个N原子连接3个C原子 | |
| B. | C3N4晶体中C-N键长比金刚石中C-C要长 | |
| C. | C3N4晶体中微粒间可能存在氢键 | |
| D. | C3N4晶体是分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验方案 |  | 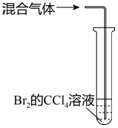 |  |  |
| 目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 测0.1mol/L氨水的pH为11:NH3•H2O?NH4++OH- | |
| B. | 用NaCl溶液做铁的吸氧腐蚀实验,O2减少:2H2O+O2+4e-=4OH- | |
| C. | 用H2、O2进行氢氧燃料电池实验,产生电流:2H2+O2$\stackrel{点燃}{→}$2H2O | |
| D. | 用NH4Cl溶液溶解Mg(OH)2,沉淀溶解:Mg(OH)2+2NH4++2NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Cd(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 1.5 | 7.2 | 5.9 |
| 沉淀完全的pH | 3.3 | 9.9 | 8.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF、HCl、HBr、HI的热稳定性依次减弱,酸性依次减弱 | |
| B. | 熔融状态下能导电的化合物一定含离子键;金属与非金属元素形成的化合物一定是离子化合物 | |
| C. | NCl3分子中所有的原子均为8电子稳定结构 | |
| D. | NaHSO4晶体中阴、阳离子的个数是1:2且熔化时破坏的是离子键和共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com