
| A. | X=0.6mol | |
| B. | 离子的物质的量关系满足n(Cl-)=5n(ClO-)+n(ClO3-) | |
| C. | 若反应中转移的电子为n mol,则有0.3<n<0.5 | |
| D. | ClO3-的物质的量范围是:0.1mol<n(ClO3-)<0.3mol |
分析 n(NaOH)=10.00mol/L×0.06L=0.6mol,
A.根据化学式NaCl、NaClO、NaClO3知,Na、Cl原子个数之比为1:1;
B.根据得失电子守恒分析;
C.氯气和NaOH反应有2NaOH+Cl2=NaCl+NaClO+H2O、6NaOH+3Cl2=6NaCl+NaClO3+3H2O,当生成NaCl和NaClO时转移电子最少,当生成NaCl和NaClO3时转移电子最多;
D.应用极端假设来分析解答,如只发生氯气和NaOH反应有2NaOH+Cl2=NaCl+NaClO+H2O,ClO3-有最小值,如果只发生6NaOH+3Cl2=6NaCl+NaClO3+3H2O,ClO3-有最大值.
解答 解:n(NaOH)=10.00mol/L×0.06L=0.6mol,
A.根据化学式NaCl、NaClO、NaClO3知,Na、Cl原子个数之比为1:1,所以与NaOH反应的n(Cl2)=$\frac{1}{2}$n(NaOH)=0.6mol×$\frac{1}{2}$=0.3mol,故A错误;
B.氯由0价变成-1价得到1mol电子,ClO-中的氯由0价变成+1价,得失到1mol的电子,而ClO3-中氯由0价变成+5价失去5mol的电子,根据得失电子守恒,可得n(Cl-)=n(ClO-)+5n(ClO3-),故B错误;
C.氯气和NaOH反应有2NaOH+Cl2=NaCl+NaClO+H2O、6 NaOH+3Cl2=6NaCl+NaClO3+3H2O,当生成NaCl和NaClO时转移电子最少,转移电子的物质的量为0.3mol,当生成NaCl和NaClO3时转移电子最多,转移电子的物质的量为0.5mol,所以如果反应中转移的电子为n mol,则0.30<n<0.5,故C正确;
D.如只发生氯气和NaOH反应有2NaOH+Cl2=NaCl+NaClO+H2O,ClO3-最小值为0,如果只发生6NaOH+3Cl2=6NaCl+NaClO3+3H2O,ClO3-最大值为0.1mol,所以ClO3-的物质的量范围是:0<n(ClO3-)<0.1mol,故D错误;
故选C.
点评 本题考查化学方程式的有关计算,侧重考查分析计算能力,根据化学式、方程式中原子守恒、转移电子守恒进行计算即可,解题方法的灵活运用是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
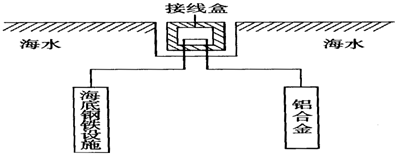
 为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.
为摆脱对石油的过度依赖,科研人员将煤液化制备汽油,并设计了汽油燃料电池,电池工作原理如图所示:一个电极通入氧气,另一电极通入汽油蒸气,电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
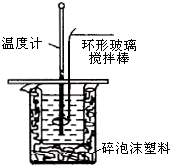 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 应用 | 解释 |
| A | 高纯硅作计算机芯片的材料 | 硅晶体在自然界中能稳定存在 |
| B | 在入海口的钢铁闸门上装一定数量的锌块防止闸门被腐蚀 | 利用外加电流的阴极保护法保护金属 |
| C | 高铁车厢采用铝合金材料 | 铝合金强度大,质量轻,不与氧气反应 |
| D | 用浸泡过高锰酸钾溶液的硅藻土保鲜水果 | 其作用是吸收水果释放出的乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用丙烷和水蒸气高温下反应制取氢气,每产生0.3molCO,同时产生0.7NA个H2分子 | |
| B. | 常温常压下,16 g O3所含的电子数为8NA | |
| C. | 标准状况下 11.2 L NO与11.2 L O2混合,充分反应后所含分子数小于0.75NA | |
| D. | 1 mol/L的Ca(ClO)2溶液中含ClO-数目一定小于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 炭具有还原性,一定条件下能将二氧化硅还原为硅 | |
| B. | 二氧化硫具有还原性,能用于漂白纸浆 | |
| C. | 碳酸钠能和酸反应,常用于治疗胃酸过多 | |
| D. | 氧化铝熔点很高,用其制造的坩埚可用于熔融烧碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 mol | B. | 14 mol | C. | 16 mol | D. | 18 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com