
【题目】氮元素可以形成多种氢化物,如NH3、N2H4等。
(1)工业上,可用次氯酸钠与氨反应制备N2H4(肼),副产物对环境友好,写出反应的化学方程式________。
(2)工业上以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:
CO(NH2)2(l)+H2O(g),该反应的平衡常数和温度关系如图所示:

①该反应的ΔH_____0(填“>”或“<”)。
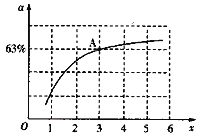
②已知原料气中的氨碳比[![]() ]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
]为x,CO2的平衡转化率为a,在一定温度和压强下,a与x的关系如图所示。a随着x的增大而增大的原因是______。图中A点处,NH3的平衡转化率为__________。
(3)①在氨水加水稀释的过程中,NH3·H2O的电离程度增大,![]() 的值_______。(填“增大”、“减小”或“不变”,)
的值_______。(填“增大”、“减小”或“不变”,)
②室温下,amol/L的(NH4)2SO4溶液的pH=5,原因是_____(用离子方程式表示),该反应的平衡常数为______(用含a的数学表达式表示)。
【答案】2NH3+NaClO=N2H4+NaCl+H2O < 增大c(NH3),平衡正向移动,从而提高CO2的转化率 42% 不变 NH4++H2O![]() NH3·H2O+H+
NH3·H2O+H+ ![]()
【解析】
(1)由题,NH3和NaClO反应副产物对环境无污染,可知产物为NaCl和H2O,反应方程式为:2NH3+NaClO=N2H4+NaCl+H2O;
(2)①由表中数据可知,温度越高,平衡常数越小,说明反应为放热反应,即ΔH<0;
②x增大说明NH3含量增加,即增大了c(NH3),平衡正向移动,从而提高CO2的转化率,故a随着x的增大而增大;由图A点处x=3,若假设原料气中n(CO2) =1mol,则n(NH3)=3mol,又CO2的转化率为63%,即CO2反应了0.63mol,由题给反应方程式可知NH3反应了1.26mol,所以NH3的转化率为:![]() ;
;
(3)①由题: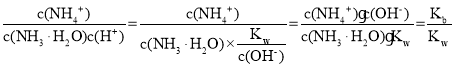 ,其中Kb表示NH3·H2O的电离平衡常数,Kw表示水的离子积常数,在温度不变的情况下,数值不变,故
,其中Kb表示NH3·H2O的电离平衡常数,Kw表示水的离子积常数,在温度不变的情况下,数值不变,故![]() 的值不变;
的值不变;
②(NH4)2SO4溶液的pH=5,原因是NH4+发生水解,离子方程式为:NH4++H2O![]() NH3·H2O+H+;amol/L的(NH4)2SO4溶液的pH=5,故c(H+)=10-5mol/L,故c(NH3·H2O)=10-5mol/L,又NH4+发生水解部分不计,故c(NH4+)=2amol/L,所以平衡常数为:
NH3·H2O+H+;amol/L的(NH4)2SO4溶液的pH=5,故c(H+)=10-5mol/L,故c(NH3·H2O)=10-5mol/L,又NH4+发生水解部分不计,故c(NH4+)=2amol/L,所以平衡常数为: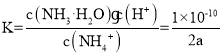


科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多巴胺是一种神经传导物质,会传递兴奋及开心的信息。其部分合成路线如下,下列说法正确的是

A. 甲在苯环上的溴代产物有2种
B. lmol乙与H2发生加成,最多消耗3molH2
C. 多巴胺分子中所有碳原子可能处在同一平面
D. 甲、乙、多巴胺3种物质均属于芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭烧瓶中,在25℃时存在如下平衡:2NO2(g)![]() N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
N2O4(g) ΔH<0,将烧瓶置于100℃的水中,则下列几项性质中不会改变的是( )
①颜色 ②平均相对分子质量 ③质量 ④压强 ⑤密度
A.①和③B.③和⑤
C.④和⑤D.②和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的一种同位素X的原子质量数为A,含N个中子,它与![]() 原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
原子组成HmX分子.在a克HmX中所含质子的物质的量是( )
A. ![]() (A-N+m)molB.
(A-N+m)molB. ![]() (A-N)molC.
(A-N)molC. ![]() (A-N)molD.
(A-N)molD. ![]() (A-N+m)mol
(A-N+m)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①![]() ;
;
②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:
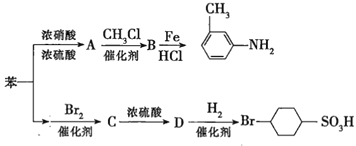
(1)![]() 是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为
是一种密度比水___________(填“大”或“小”)的无色液体,苯转化为![]() 的化学方程式是______。
的化学方程式是______。
(2)在“苯![]() ”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
”的转化过程中,属于取代反应的是______(填序号,下同),属于加成反应的是_________。
(3)有机物![]() 苯环上的二氯代物有__________种结构;
苯环上的二氯代物有__________种结构;![]() 的所有原子____(填“在”或“不在”)同一平面上。
的所有原子____(填“在”或“不在”)同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属是重要但又匮乏的战略资源。从废旧锂电池的电极材料(主要为附在铝箔上的LiCoO2,还有少量铁的氧化物)中回收钴的一种工艺流程如下

请回答下列问题
(1)在焰色反应实验中,可用钴玻璃观察钾元素的焰色,该钴玻璃的颜色为_______。
(2)”溶液A中溶质除NaOH外,还有______。“钴渣”中LiCoO2溶解时的离子方程式为___________________________________。
(3)在“滤液”中加入20﹪Na2CO3溶液,目的是_________;检验“滤液1”中Fe2+是否完全被氧化、不能用酸性KMnO4溶液,原因是___________________________。
(4)如将硫酸改为盐酸浸取“钴渣“,也可得到Co2+。
①浸取时,为提高”钴渣”中浸取率,可采取的措施有_____________(任写一条)。
②工业生产中一般不用盐酸浸取“钴渣”,其原因是_____________________。
(5)”钴沉淀”的化学式可表示为CoCO3·yCo(OH)2。称取5.17g该样品置于硬质玻璃管中,在氮气中加热.使样品完全分解为CoO,生成的气体依次导入足量的浓硫酸和碱石灰中,二者分别增重0.54g和0.88g。则“钴沉淀”的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是
A.气态氢化物的稳定性:H2O>NH3
B.氢元素与其他元素可形成共价化合物或离子化合物
C.如图所示实验可证明元素的非金属性:Cl>C>Si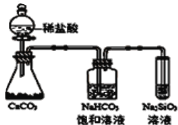
D.人工合成的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示物质间满足每一步转化均能实现的是( )
A.N2(g)![]() NO(g)
NO(g) ![]() NaNO2(aq)
NaNO2(aq)
B.NaCl(aq) ![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
C.![]()
D.Fe3O4(s) ![]() Fe(s)
Fe(s) ![]() Fe(NO3)3(aq)
Fe(NO3)3(aq)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com