
| A. | SO2+O2$?_{加热}^{催化剂}$ 2SO 3△H=-196.6 kJ/mol | |
| B. | H2(g)+$\frac{1}{2}$O2(g)═H2O( l )△H=-285.8 kJ/mol | |
| C. | 2H2( g )+O2( g )═2H2O ( l )△H=+571.6 kJ/mol | |
| D. | C(s)+O2( g )═CO2(g)△H=+393.5 kJ/mol |
分析 A.没有标出物质的聚集状态;
B.H2与O2的化合反应为放热反应;
C.氢气的燃烧为放热反应;
D.C的燃烧为放热反应.
解答 解:A.没有标出物质的聚集状态,正确的写法为2SO2(g)+O2(g)?2SO3(g);△H=-196.6kJ/mol,故A错误;
B.H2与O2的化合反应为放热反应,符合热化学方程式的书写要求,故B正确;
C.氢气的燃烧为放热反应,正确的写法为2H2( g )+O2( g )═2H2O ( l )△H=-571.6 kJ/mol,故C错误;
D.C的燃烧为放热反应,正确的写法为C(s)+O2( g )═CO2(g)△H=-393.5 kJ/mol,故D错误.
故选B.
点评 本题考查热化学方程式的书写,题目难度不大,注意热化学方程式的书写注意事项.


科目:高中化学 来源: 题型:解答题
 ;
;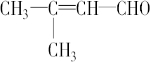 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上常以海带或其它海产品为原料提取碘 | |
| B. | 炼铁和制玻璃的工业中都要用到石灰石 | |
| C. | 氯气通入石灰乳中制漂白粉 | |
| D. | 电解氯化钠溶液制金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
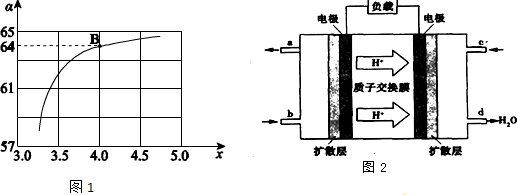
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气通入水中:C12+H2O?H++C1-+HClO | |
| B. | 向Mg(HCO3)2溶液中加入过量的澄清石灰水:Mg2++2HCO3-+2OH一+Ca2+═MgCO3+CaCO3↓+2H2O | |
| C. | 将适量的CO2通入Ca(C1O)2溶液中:Ca2++2C1O-+CO2+H2O═2HC1O+CaCO3↓ | |
| D. | Ba(OH)2溶液中加入过量的Al2(SO4)3溶液:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ②③④ | C. | ①②③ | D. | ①②④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO${\;}_{4}^{2-}$ | B. | CO${\;}_{3}^{2-}$ | C. | Al3+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe2+ | Fe3+ | Cu2+ | Mn2+ | |
| 开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
| 完全沉淀的pH | 9.7 | 3.7 | 7.8 | 10.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com