
100毫升含HNO3、H2SO4的稀溶液中,加入9.6克铜充分反应,铜全溶,产生2.24升NO(标准状况)。同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和。
计算原混合酸中HNO3的物质的量浓度的取值范围_________________________
H2SO4的物质的量浓度的取值范围_______________________。
1 mol/L≤C(HNO3)<5 mol/L, 0<C(H2SO4)≤2 mol/L
解析试题分析:本题用极限法考虑,铜与混酸反应的离子方程式为3Cu+2NO3-+8H+="3" Cu 2++2NO↑+4 H2O,2.24L标准状况下的NO的物质的量是0.1mol,若硝酸全部被还原为NO,则硝酸的物质的量最小是0.1mol,浓度是1mol/L;同体积的混合酸恰好与250毫升2mol/L的NaOH完全中和,说明混酸中的氢离子的物质的量为0.5mol,若全部是硝酸提供,则硝酸的物质的量最大是0.5mol,浓度是5mol/L,所以硝酸的物质的量浓度的范围是1 mol/L≤C(HNO3)<5 mol/L;当硝酸的物质的量最小时,硫酸的物质的量最大是0.2mol,所以浓度的最大值是2mol/L,硝酸物质的量最大时,硫酸的物质的量最小为0,实际是硝酸和硫酸的混合酸,所以硫酸的浓度的取值范围是 0<C(H2SO4)≤2 mol/L。
考点:考查金属与酸的计算,酸的浓度的计算


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:单选题
取等质量的钠进行下列实验,其中生成氢气最多的是
| A.将钠投入足量的水中 |
| B.将钠投入足量的稀硫酸中 |
| C.将钠用铝箔包好并刺一些小孔,再放入足量的水中 |
| D.将钠用耐热塑料薄膜包好并刺一些小孔,再放入足量的水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: _______________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。 
正极反应____________________________;
负极反应____________________________。
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答下列问题: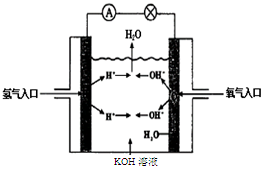
①负极反应式为 溶液PH (填“增大”、“不变”或“减小”)。
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2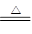 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
反应Ⅰ中的还原剂是 ,7 gLi可吸收标况下H2 L,此时转移电子 moL。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(15分)用FeCl3酸性溶液脱除H2S后的废液,通过控制电压电解得以再生。某同学使用石墨电极,在不同电压(x)下电解pH=1的0.1mol/LFeCl2溶液,研究废液再生机理。记录如下(a、b、c代表电压值:)
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| I | x≥a | 电极附近出现黄色,有气泡产生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 电极附近出现黄色,无气泡产生 | 有Fe3+、无Cl2 |
| III | b>x>0 | 无明显变化 | 无Fe3+、无Cl2 |
| 序号 | 电压/V | 阳极现象 | 检验阳极产物 |
| IV | a>x≥c | 无明显变化 | 有Cl2 |
| V | c>x≥b | 无明显变化 | 无Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)辉铜矿是冶炼铜的重要原料。
(1)工业上冶炼粗铜的某种反应为:Cu2S+O2=2Cu+SO2
①当产生标况下11.2L气体时,转移电子数目为 ;
②将粗铜进行电解精炼,粗铜应与外电源的 极相接;若精炼某种仅含杂质锌的粗铜,通电一段时间后测得阴极增重ag,电解质溶液增重bg,则粗铜中含锌的质量分数为 ;
(2)将辉铜矿、软锰矿做如下处理,可以制得碱式碳酸铜:
①铜单质放置于潮湿空气中,容易生成碱式碳酸铜,反应化学方程式是 ;
②步骤Ⅱ中,碳酸氢铵参与反应的离子方程式为 ;
③步骤Ⅰ中发生如下3个反应,已知反应i)中生成的硫酸铁起催化作用。请写出反应iii)的化学方程式。
i)Fe2O3+3H2SO4 =Fe2(SO4)3+3H2O
ii) Cu2S+ Fe2(SO4)3 =CuSO4+CuS+2FeSO4
iii)
④步骤Ⅱ中调节pH后的溶液中,铜离子浓度最大不能超过 mol/L。
(已知Ksp[(Cu(OH)2)]=2×10-a)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯化铁和高铁酸钾都是常见的水处理剂。下图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程。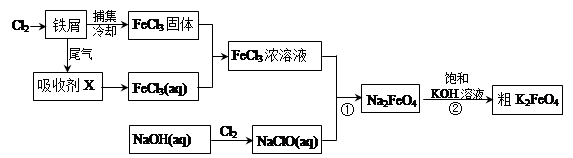
请回答下列问题:
(1)氯化铁有多种用途:
①氯化铁做净水剂。请用离子方程式表示其原理____________ __________;
②工业上常用FeCl3溶液腐蚀铜印刷线路板。这是利用了FeCl3较强的__________性。
(2)吸收剂X的化学式为 。为检验吸收剂是否已完全转化为FeCl3溶液,有人设计用酸性高锰酸钾溶液,但很快被否定,理由是(用离子方程式表示) 。正确的检验方法是:取少量待测液,加入 (写化学式)溶液,若无深蓝色沉淀产生,则证明转化完全。
(3)碱性条件下反应①的离子方程式为____________________________________。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+Na2FeO4  K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
K2FeO4+2NaOH,请根据相关反应原理分析反应能发生的原因 。
(5)将粗K2FeO4产品经重结晶、过滤、 、 ,即得较纯净的K2FeO4。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(8分)取100mL FeCl3、AlCl3的混合溶液,逐滴加入物质的量浓度为1 mol·L-1的NaOH溶液,生成沉淀的物质的量随加入NaOH溶液的体积(单位为mL)关系如下图所示。
按要求回答:
(1)a点对应沉淀的物质的量是 mol;此时溶液中的溶质是 。
(2)b点对应沉淀的物质的量是 mol;原溶液中c(AlCl3)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某研究性学习小组就Na2O2的有关性质探究如下:向滴有酚酞的水中
投入一定量的Na2O2,观察到先有大量气泡产生,溶液变红,过一会儿溶液又变为无色。
对上述实验中溶液变红,过一会儿又退色的原因,甲、乙两同学提出了不同的解释:
甲同学认为是Na2O2与水反应放出氧气,氧气有氧化性,将酚酞氧化而使溶液退色;
乙同学则认为是Na2O2与水反应时产生了H2O2,H2O2的强氧化性使酚酞退色。
(1)乙同学设计了如下实验来证明自己的猜想是正确的:在滴有酚酞的氢氧化钠溶液中滴加3%的H2O2溶液并振荡。
①若乙同学的猜想正确,可观察到的现象是 。
②甲同学针对乙同学的上述验证实验提出还应增做实验才能更直接证明Na2O2与水反应生成了H2O2,甲同学提出要增加的实验是什么?
(2)试设计简单实验证明甲同学的解释是否正确(画出简易装置图,说明简要步骤)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com