
【题目】水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是( )
A.氨水的电离程度B.c(NH3·H2O)/c(OH-)
C.c(H+)和c(OH-)的乘积D.OH-的物质的量
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各表述正确的是( )
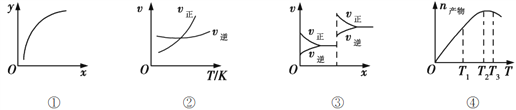
A. 图①表示在恒容容器中MgSO4(s) + CO(g)![]() MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
MgO(s) + CO2(g) + SO2(g),横坐标代表硫酸镁的质量,纵坐标可代表CO的转化率
B. 图②表示其他条件一定时,反应A(g)+3B(g)![]() 2C(g)的反应速率随温度变化的图像,正反应ΔH>0
2C(g)的反应速率随温度变化的图像,正反应ΔH>0
C. 图③对应的反应一定是非等体积反应加压后平衡移动的变化情况
D. 恒压密闭容器中加入一定量A、B,发生反应A(g)+3B(g)![]() 2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
2C(g),图④表示反应过程中不断升高温度,产物C物质的量变化规律,则正反应方向吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(1)ΔH=-57.3kJ·mol-1、计算下列中和反应放出的热量
(1)用20g NaOH配成的稀溶液跟足量的稀盐酸反应,能放出___________kJ的热量
(2)用1mol醋酸稀溶液和足量的NaOH稀溶液反应,放出的热量 __________57.3kJ(填 “>”、“<”、或“=”)理由是______________________________________ 。
(3)1L0.1mol/L NaOH溶液分别与①醋酸溶液;②浓硫酸;③稀硝酸恰好反应时,放出的热量分别为Q1、Q2、Q3(单位kJ)。则它们由大到小的顺序为 _______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有 A、B、C三种元素,其中 A、C两元素能形成化合物 AC。已知 B和 C原子的核外电子层数相同,且最外层电子数之和为10,A2+和B原子具有相同的电子层数。C原子最外层电子数为次外层电子数的3倍,请回答以下问题:
(1)A、B、C三种元素的名称分别是:A________、B________、C_______。
(2)写出 A离子的结构示意图__________。
(3)化合物 AC中存在的化学键为_______键,写出 AC 的电子式____________。
(4)写出化合物BC2的结构式____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ·mol1
该催化重整反应的ΔH==______ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
积碳反应 CH4(g)=C(s)+2H2(g) | 消碳反应 CO2(g)+C(s)=2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/ (kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________填标号)。

A.K积、K消均增加 B.v积减小,v消增加
C.K积减小,K消增加 D.v消增加的倍数比v积增加的倍数大
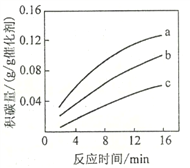
②在一定温度下,测得某催化剂上沉积碳的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述正确的是

A. lmol该有机物在镍催化下可消耗3molH2
B. 该有机物既能发生氧化反应又能发生还原反应
C. 该有机物的分子式为C12H18O2
D. 1mol该有机物能消耗2 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出基态Fe2+的核外电子排布式______________________;基态C1原子电子占据最高能级的电子云轮廓图为___________形。
(2)SO42-中心原子的轨道杂化类型为___________;NO3-的空间构型为___________。
(3)萤石晶胞结构如图I所示,则Ca2+的配位数是___________,萤石的化学式为 ___________。

(4)NiO氧化镍)晶胞结构如图Ⅱ所示,则每个Ni2+周围与其等距离的Ni2+有___________个;若Ni2+与最邻近O2-的核间距为a×10-8cm,则NiO晶体的密度为___________g·cm-3(列出计算式)(已知NiO的摩尔质量为74.7g·mol-1,阿伏加德罗常数的值为NA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【题目】一定温度下,反应N2(g)+3H2(g)![]() 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
A. c(N2):c(H2):c(NH3)=1:3:2
B. N2、H2和NH3的物质的量分数不再改变
C. N2与H2的物质的量之和是NH3的物质的量的2倍
D. 单位时间里每增加lmolN2,同时增加3molH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com