

分析 由制备流程可知,反应I发生2NaOH+Cl2=NaCl+NaClO+H2O,反应II发生2Fe(NO3)3+10NaOH+3NaClO=2Na2FeO4+6NaNO3+3NaCl+5H2O,分离除盐后,将Na2FeO4在KOH溶液中溶解,过滤除去杂质NaCl,且加入饱和KOH溶液后,将Na2FeO4转化为溶解度更小的K2FeO4,反应方程式为Na2FeO4+2KOH=K2FeO4+2NaOH,冷却结晶,过滤,高铁酸钾易溶于水,难溶于异丙醇,用异丙醇代替水洗涤产品可以减少高铁酸钾的损耗,同时洗去高铁酸钾晶体表面的KOH和其他杂质,得到纯产品高铁酸钾,以此来解答.
解答 解:(1)①洗涤粗品时选用异丙醇而不用水的理由是减少高铁酸钾的溶解损失,故答案为:减少高铁酸钾的溶解损失;
②反应I中氯气与NaOH反应,其化学方程式为2NaOH+Cl2=NaCl+NaClO+H2O,故答案为:2NaOH+Cl2=NaCl+NaClO+H2O;
③反应II为2Fe(NO3)3+10NaOH+3NaClO=2Na2FeO4+6NaNO3+3NaCl+5H2O,离子反应为3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O,
故答案为:3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O;
④25℃时Fe(OH)3的Ksp=4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,生成沉淀时c(OH-)=$\root{3}{\frac{4.0×1{0}^{-38}}{4.0×1{0}^{-5}}}$=10-11mol/L,由Kw可知c(H+)=10-3mol/L,即需要调整pH=3,故答案为:3;
(2)①加入饱和KOH溶液的目的是增大K+浓度,促进K2FeO4晶体析出,故答案为:增大K+浓度,促进K2FeO4晶体析出;
②由以上信息可知:发生Na2FeO4+2KOH=K2FeO4+2NaOH,析出K2FeO4,则高铁酸钾的溶解度比高铁酸钠小,故答案为:小;
(3)发生Fe2O3+3KNO3+4KOH═2K2FeO4+3KNO2+2H2O,N元素的化合价降低,Fe元素的化合价升高,则KNO3为氧化剂,Fe2O3为还原剂,由反应可知氧化剂与还原剂的物质的量之比为3:1,
故答案为:3:1.
点评 本题考查物质的制备实验,为高频考点,把握制备流程中的反应、混合物分离提纯为解答的关键,侧重分析与应用能力的考查,注意氧化还原反应、Ksp的计算,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | v(NO2)=v(O2) | |
| B. | 反应器中的压强不随时间变化而变化 | |
| C. | 混合气体的颜色保持不变 | |
| D. | 混合气体的平均相对分子质量保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和盐酸不是化台物,能导电是电解质 | |
| B. | 可用过的量氢氧化钠区别镁离子和铝离子 | |
| C. | 钾的焰色反应是白色的 | |
| D. | 二氧化硫有毒,不能漂白食品,亦不能用作食品防腐剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol•L-1的NaClO 溶液中含有ClO-的数目小于NA | |
| B. | 1.5 g甲醛、冰醋酸的混合物中原子总数为0.2NA | |
| C. | 0.2mol羟基中含有的电子个数为2NA | |
| D. | 104g苯乙烯中含有的碳碳双键个数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子结构示意图 ,可以表示12C原子或13C原子 ,可以表示12C原子或13C原子 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | 次氯酸的电子式 | |
| D. | CO2的比例模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n | B. | $\frac{n}{m}$ | C. | $\frac{12n}{m}$ | D. | $\frac{n}{{N}_{A}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ,用电子式表示C、D两元素形成化学键的过程:
,用电子式表示C、D两元素形成化学键的过程: .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的还原剂是NH4+ | |
| B. | 氧化剂与还原剂的物质的量之比是2:3 | |
| C. | 消耗1mol氧化剂,转移2mol电子 | |
| D. | 反应后溶液酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 反应类型加聚反应
反应类型加聚反应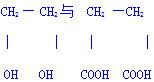 的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH
的聚合反应n HOCH2CH2OH+n HOOCCH2CH2COOH 
 +(2n-1)H2O反应类型缩聚反应
+(2n-1)H2O反应类型缩聚反应 反应类型取代反应
反应类型取代反应查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com