
某工厂废水中含游离态氯,通过下列实验测定其浓度
①取水样20.0mL于锥形瓶,加入10.0 mLKI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01 mol·L-1的Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+ 2Na2S2O3 =2NaI+Na2S4O6。
2Na2S2O3 =2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是______________。
(2) 步骤②应使用____________式滴定管。
(3)试描述滴定终点的现象:_______________________________。
(4)若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为______________ 。
(5)请指出实验中的一处明显错误:_______________________________。
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2017届福建省高三上学期期中化学试卷(解析版) 题型:选择题
维生素C的结构简式如图所示。下列有关说法正确的是
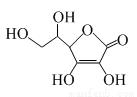
A.维生素C所含的官能团有羟基、羧基、碳碳双键
B.维生素C能和溴水、酸性高锰酸钾溶液反应
C.维生素C的分子式为C6H6O6
D.维生素C能发生加成反应、氧化反应,不能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年山西省高一12月月考化学试卷(解析版) 题型:选择题
氧化还原反应中,水的作用可以是氧化剂、还原剂、既是氧化剂又是还原剂、既非氧化剂又非还原剂等。下列反应与Br2+ SO2+ 2H2O = H2SO4+ 2HBr相比较,水的作用不相同的是
A.2Al+2NaOH+2H2O=2NaA1O2+3H2↑
B.4Fe(OH)2+O2+2H2O=4Fe(OH)3
C.BrCl+H2O=HCl+HBrO
D.2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省宜春市高一上月考二化学卷(解析版) 题型:选择题
下列物质中,属于电解质但 不能导电的是( )
不能导电的是( )
A.四氯化碳 B.熔融的氯化铝 C.液态氯化钠 D.石墨
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省宜春市高一上月考二化学卷(解析版) 题型:选择题
下列实验基本操作(或实验注意事项)中,主要考虑实验安全的是( )
A. 实验剩余的药品不能放回原试剂瓶 B. 可燃性气体的验纯
C. 气体实验装置在实验前进行气密性检查 D. 滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省宜春市高二上月考二化学卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
①0.1 mol·L-1NaAlO2溶液:H+、Na+、Cl-、SO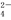
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
③水电离的H+浓度为10-12mol·L-1的溶液中:Cl-、CO32-、NO3-、SO32-
④加入Mg能放出H2的溶液中:Mg2+、NH4+、Cl-、K+、SO42-、NO3-
⑤使甲基橙变黄的溶液中:Fe2+、MnO4-、NO3-、Na+、SO42-
⑥中性溶液中:Fe3+、Al3+、NO3-、Cl-
A.②④⑥ B.②⑥ C.② D .①③⑤
.①③⑤
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省宜春市高二上月考二化学卷(解析版) 题型:选择题
甲酸的下列性质中,可以证明它是弱电解质的是
A.甲酸以任意比与水互溶
B.0.1mol/L甲酸溶液的c(H+)=10-3mol/L
C.10mL 1mol/L甲酸恰好与10mL  1mol/L NaOH溶液完全反应
1mol/L NaOH溶液完全反应
D.甲酸溶液的导电性比一元强酸溶液的弱
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省饶阳县高一上期中化学试卷(解析版) 题型:选择题
下列可以大量共存且溶液是无色的离子组是( )。
A.H+、Na+、NO3-、Cu2+ B.Ba2+、Mg2+、Cl-、SO42-
C.H+、K+、OH-、NO3- D.NO3-、SO42-、K+、Mg2+
查看答案和解析>>
科目:高中化学 来源:2016-2017学年贵州省高二上期中化学卷(解析版) 题型:填空题
氨气是重要的化工原料
(1)已知: N2(g)+O2(g)= 2NO(g) △H = +180.5kJ·mol-1
4NH3(g)+5O2(g)= 4NO(g)+6H2O(g) △H = -905kJ·mol-1
2H2(g)+O2(g)= 2H2O(g) △H = -483.6kJ·mol-1
写出氨气在高温高压催化剂条件下生成氮气和氢气的热化学方程式:
;如果在1L密闭容器中,3mol NH3 在等温条件下充分反应,2min后达到平衡,平衡时的反应热为92.4kJ ,则在这段时间内v(H2)= ;保持温度不变,将起始NH3的物质的量调整为8mol,平衡时NH3的转化率为  。
。
(2)一定条件下,某密闭容器中发生反应:4NH3(g)+5O2(g) 4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
4NO(g)+6H2O(g)。在一定体积的密闭容器中,为使该反应的反应速率增大,且平衡向正反应方向移动,下列措施中可采用的是 (填字母代号)。
A.增大压强 B.适当升高温度 C.增大O2的浓度 D.选择高效催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com