
| ||
| △ |
| ||
| △ |
| ||
| ||


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
| A、等质量的N2和CO所含分子数均为NA |
| B、常温常压下,1.06 g Na2CO3含有的Na+离子数为0.2NA |
| C、2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
| D、常温常压下48gO2和48gO3含有的氧原子数均为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入粉末质量/g | 13.68 | 27.36 | 34.20 |
| 生成气体的体积(标准状况)/L | 2.912 | 5.824 | 6.720 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是研究铜与浓硫酸的反应装置:
如图是研究铜与浓硫酸的反应装置:| 资料1 |
| ||||||||||||
| 资料2 | X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种. |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、合成氨生产过程中升高温度可加快反应速率,缩短生产周期,故温度越高越好 |
| B、硫酸工业中,使用催化剂是为了提高SO2转化为SO3的转化率 |
| C、电解精炼铜时,精铜作阴极 |
| D、电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室 |
查看答案和解析>>
科目:高中化学 来源: 题型:

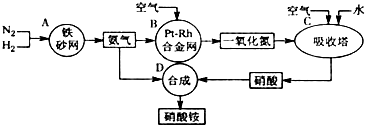
| A、若图I为合成氨,则其中N2、H2可循环使用 |
| B、若图I为合成SO3,则其中SO2、O2可循环使用 |
| C、若图Ⅱ为电解熔融MgCl2得到镁,则其中HCl可循环使用 |
| D、若图Ⅲ为氨氧化法制硝酸,则其中NO2可循环使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
某研究性学习小组利用以下材料来探究NH3的还原性,部分实验装置如下图.材料1:NH3是强还原剂,能将某些金属氧化物还原为金属单质或低价态的氧化物.如:2NH3+3CuO
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO2)×c(H2) |
| c(CO)×c(H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com