
分析 (1)根据碳单质的性质结合碳单质和硅单质性质的相似性来回答;
(2)根据盖斯定律来计算化学反应的焓变,并书写热化学方程式;
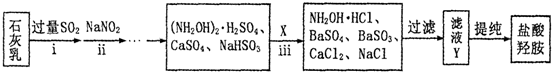
(3)①根据图示信息确定制取NH4H2Cit的pH范围;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=cmol/L,CH3COOH?CH3COO-+H+电离常数Ka=$\frac{c(CH{\;}_{3}COO{\;}^{-})c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$以此计算.
解答 解:(1)根据碳单质的性质可以和氧气在点燃下反应,可以和浓硝酸加热下反应,碳单质可以和氟气之间反应,故答案为:ABC;
(2)已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=a kJ•mol-1;
②CH3OH(g)═CO(g)+2H2(g)△H=bkJ•mol-1;
根据盖斯定律,反应CH4(g)+H2O(g)=CH3OH(g)+H2(g),可以是①-②得到,所以该反应的△H=(a-b)kJ/mol,
故答案为:CH4(g)+H2O(g)=CH3OH(g)+H2(g)△H=(a-b)kJ/mol;
(3)①根据图示信息知道,H2Cit-存在的pH范围大约在4左右,故答案为:3.8~4.2;
②根据图示信息知道:柠檬酸和一定量氨水反应所得溶液的pH约为6.7时,溶液中存在HCit2-、Cit3-等离子,所以反应的离子方程式为2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O,故答案为:2H3Cit+5NH3•H2O=HCit2-+Cit3-+5NH4++5H2O;
(4)呈中性则c(H+)=c(OH-)=10-7mol/L,c(Na+)=c(CH3COO-)=cmol/L,所以CH3COOH?CH3COO-+H+用含b、c的代数式表示CH3COOH的电离常数Ka=$\frac{c(CH{\;}_{3}COO{\;}^{-})c(H{\;}^{+})}{c(CH{\;}_{3}COOH)}$=$\frac{10{\;}^{-7}×c}{b-c}$,
故答案为:$\frac{10{\;}^{-7}×c}{b-c}$.
点评 本题涉及碳单质的性质、电化学、热化学等方面的知识的考查,注意知识的归纳和梳理是关键,难度中等.


科目:高中化学 来源: 题型:填空题
 ;
;
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
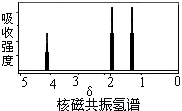
| A. | CH3COOCH2CH3 | B. | CH3CH=CHCH3 | C. | CH3CH2CH3 | D. | CH3CHOHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
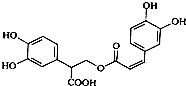
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol H2发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
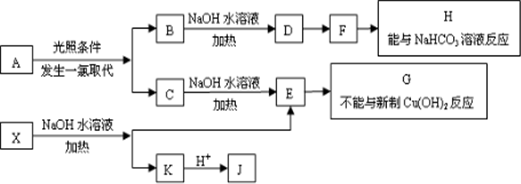
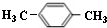 .
.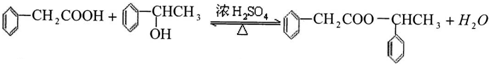 ;该反应类型是酯化反应(或取代反应).
;该反应类型是酯化反应(或取代反应).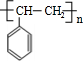 .
.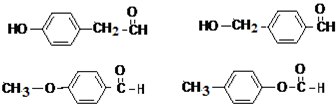 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
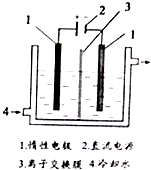 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
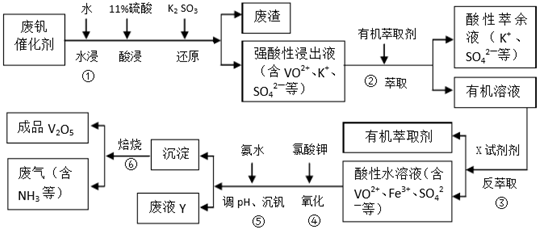
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
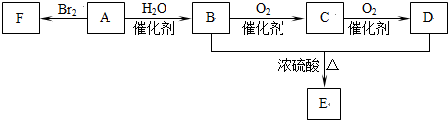
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com