
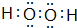 .
.分析 X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,则X为O元素,Q与X最高能层上的电子数相同,二者同主族,Y和X、Z、Q均相邻,故X、Y、Q同族,且Y在中间,则Y为硫,Q为硒,又Y、Z相邻,且Z的原子序数大于Y,故Z为氯,W有7个能级,分别为1s、2s、2p、3s、3p、3d、4s,且最高能级没有未成对电子,则3d能级上有10个电子,根据其形成的两种氧化物确定W为铜.
(1)O能与原子序数最小的元素H形成原子个数比为1:1的分子H2O2;
(2)Cu原子的4s能级、3d能级各失去1个电子形成Cu2+;
(3)Z的单质为氯气,水溶液呈黄绿色;在氯水中通人SO2,发生氧化还原反应,溶液颜色褪去;
(4)同一周期从左至右第一电离能呈增大起始;SiO2为典型的原子晶体.
(5)根据盖斯定律可以计算得到反应热,写出热化学方程式;
(6)可以想象为在P4(正四面体结构)分子中的每个P-P键中放入一个S原子,故有6个极性键、3个非极性键.
解答 解:X、Y、Z、W、Q五种元素原子序数依次增大,X为地壳中含量最高的元素,则X为O元素,Q与X最高能层上的电子数相同,二者同主族,Y和X、Z、Q均相邻,故X、Y、Q同族,且Y在中间,则Y为硫,Q为硒,又Y、Z相邻,且Z的原子序数大于Y,故Z为氯,W有7个能级,分别为1s、2s、2p、3s、3p、3d、4s,且最高能级没有未成对电子,则3d能级上有10个电子,根据其形成的两种氧化物确定W为铜.
(1)O能与原子序数最小的元素H形成原子个数比为1:1的分子H2O2,电子式为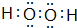 ,
,
故答案为: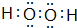 ;
;
(2)Cu2+的核外电子排布式为1s22s22p63s23p63d9,
故答案为:1s22s22p63s23p63d9;
(3)Z的单质为氯气,水溶液呈黄绿色;在氯水中通入SO2,发生氧化还原反应,溶液颜色褪去,反应方程式为:Cl2+SO2+2H2O=2HCl+H2SO4,
故答案为:黄绿色;Cl2+SO2+2H2O=2HCl+H2SO4;
(4)同一周期从左至右第一电离能车呈增大趋势,故第一电离能S<Cl;SiO2为典型的原子晶体,
故答案为:<;原子晶体;
(5)已知:①.2CO(g)+O2(g)═2CO2(g)△H=-566.0kJ•mol-1
②.N2(g)+O2(g)═2NO(g)△H=+189.5kJ•mol-1
③.2NO(g)+O2(g)═2NO2(g)△H=-112.97kJ•mol-1
根据盖斯定律,①×2-②-③可得:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1,
故答案为:2NO2(g)+4CO(g)=N2(g)+4CO2(g)△H=-1208.53 kJ•mol-1;
(6)可以想象为在P4(正四面体结构)分子中的每个P-P键中放入一个S原子,故有6个极性键、3个非极性键,
故答案为:6;3.
点评 本题以元素推断为载体,考查原子结构、分子结构、元素周期律、元素及化合物、热化学方程式的书写、盖斯定律等知识,注意对基础知识的理解掌握.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ③④ | C. | ①② | D. | ①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
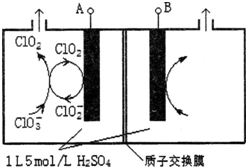 二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.
二氧化氯(ClO2)是国内外公认的高效、广谱、快速、安全无毒的杀菌消毒剂,被称为“第4代消毒剂”.工业上可采用氯酸钠(NaClO3)或亚氯酸钠(NaClO2)为原料制备ClO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | E | F | G | H | I | J | |
| 原子半径 (10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | 1.02 | 0.037 |
| 最高或最低 化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | +6 | +1 | |
| -2 | -3 | -1 | -3 | -2 |
 ;
;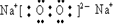 .
. ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的非金属性顺序为R>Y>W | |
| B. | R与其他三种元素均能形成共价化合物 | |
| C. | 简单氢化物的热稳定性顺序为R>W>Y | |
| D. | 原子半径次序为W>R>X>Y |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | 实验操作 | 现象 | 结论 |
| A | NH4HSO3受热分解产生的气体全部通入Ba(NO3)2溶液中 | 产生白色沉淀 | 沉淀为BaSO4 |
| B | 浓度均为0.1mol•L-1Zn2+和Cu2+混合溶液中滴入少量Na2S溶液 | 产生黑色沉淀 | Ksp(CuS)<Ksp(ZnS) |
| C | 2mLpH=3的盐酸和2mLpH=3醋酸,同时分别加入足量相同的锌粉 | 反应速率不同 | 较快的为盐酸 |
| D | 待测液X中加入KSCN溶液无明显现象,加入H2O2酸性溶液 | 溶液变为红色 | X中含Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com