
【题目】控制适当的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如图所示的原电池,下列判断错误的是
2Fe2++I2设计成如图所示的原电池,下列判断错误的是
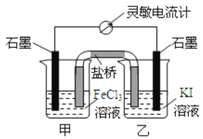
A. 反应开始时,乙中电极反应为2I--2e-=I2
B. 反应开始时,甲中石墨电极上发生还原反应
C. 电流计读数为零时,反应达到化学平衡状态
D. 平衡时乙中溶入碘后,甲池的石墨电极为正极
科目:高中化学 来源: 题型:
【题目】如图,电源A是氢氧燃料电池(电解质溶液为KOH溶液),B为浸透饱和氯化钠溶液的pH试纸,甲为电解池。请填空:
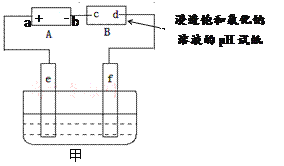
(1)电源A中a极应通入的气体是______,b极上发生的电极反应是_______________。
(2)通电后,试纸上c极称为_____极,实验中发现该极周围pH试纸变蓝色,原因是_____(结合电极反应式说明)。
(3)实验中d极周围可能观察到的现象是的______________________________。
(4)①若利用甲实现铁上镀锌,应将铁接_________极(填“e”或“f”);
②若利用甲实现粗铜的精炼,f电极上的反应是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法正确的是( )
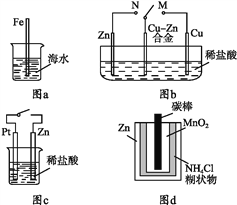
A. 图a中,插入海水中的铁棒,越靠近底端腐蚀越严重
B. 图b中,开关由M改置于N时,Cu-Zn合金的腐蚀速率减小
C. 图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大
D. 图d中,Zn-MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 化学变化过程是原子的重新组合过程
B. 化学反应的焓变用ΔH表示,单位是kJ·mol-1
C. 化学反应的焓变ΔH越大,表示放热越多
D. 化学反应中的能量变化不都是以热能形式表现出来的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组设计不同实验方案比较Cu2+、Ag+ 的氧化性。
(1)方案1:通过置换反应比较
向酸化的AgNO3溶液插入铜丝,析出黑色固体,溶液变蓝。反应的离子方程式是_______,说明氧化性Ag+>Cu2+。
(2)方案2:通过Cu2+、Ag+ 分别与同一物质反应进行比较
实验 | 试剂 | 编号及现象 | |
试管 | 滴管 | ||
| 1.0 mol/L KI溶液 | 1.0 mol/L AgNO3溶液 | Ⅰ.产生黄色沉淀,溶液无色 |
1.0 mol/L CuSO4溶液 | Ⅱ.产生白色沉淀A,溶液变黄 | ||
① 经检验,Ⅰ中溶液不含I2,黄色沉淀是________。
② 经检验,Ⅱ中溶液含I2。推测Cu2+做氧化剂,白色沉淀A是CuI。确认A的实验如下:
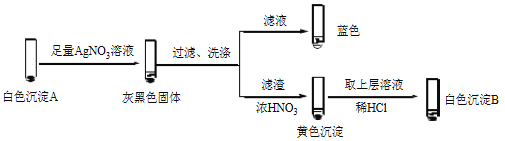
a.检验滤液无I2。溶液呈蓝色说明溶液含有________(填离子符号)。
b.白色沉淀B是________。
c.白色沉淀A与AgNO3溶液反应的离子方程式是____,说明氧化性Ag+>Cu2+。
(3)分析方案2中Ag+ 未能氧化I- ,但Cu2+氧化了I-的原因,设计实验如下:
编号 | 实验1 | 实验2 | 实验3 |
实验 |
|
|
|
现象 | 无明显变化 | a中溶液较快变棕黄色,b中电极 上析出银;电流计指针偏转 | c中溶液较慢变浅黄色; 电流计指针偏转 |
(电极均为石墨,溶液浓度均为 1 mol/L,b、d中溶液pH≈4)
① a中溶液呈棕黄色的原因是_______(用电极反应式表示)。
② “实验3”不能说明Cu2+氧化了I-。依据是空气中的氧气也有氧化作用,设计实验证实了该依据,实验方案及现象是_______。
③ 方案2中,Cu2+能氧化I-,而Ag+未能氧化I-的原因:_______。
(资料:Ag+ + I- = AgI↓ K1 =1.2×1016;2Ag+ + 2I- = 2Ag↓+ I2 K2 = 8.7×108)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上有一种加入蛋白酶的洗衣粉,能将衣物的汗渍、血渍等蛋白质水解而除去。下列衣料中,不能用加酶洗衣粉洗涤的是
①棉织品 ②毛织品 ③腈纶织品 ④丝织品
A. ②④ B. ①② C. ①③ D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G―→Q+NaCl ②Q+H2O![]() X+H2
X+H2
③Y+NaOH―→G+Q+H2O
④Z+NaOH―→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是( )
A. G、Y、Q、Z、X B. X、Z、Q、G、Y
C. X、Z、Q、Y、G D. G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的化合物是优良的催化剂,并可用于干电池原料生产等。
(1)普通锌锰干电池的反应为:2MnO2+Zn+2NH4Cl=2MnO(OH)+Zn(NH3)2Cl2。
①MnO(OH)中锰元素的化合价为_________。电解质的主要成分是_____________________(填化学式);
②与普通锌锰电池相比,碱性锌锰电池_________(填序号)
a.比能量大 b.电流小
c.存储时间长 d.不能连续放电
(2)向普通锌锰废电池还原后的废液(含有Mn2+、Fe2+、Zn2+等)中逐滴滴加Na2S溶液,最先生成的沉淀为________________________(填化学式)。
已知:Ksp(MnS)=1.4×10-15,Ksp(ZnS)=2.9×10-25,Ksp(FeS)=6×10-18
(3)合成甲醇的反应为:CO2(g)+3H2(g)![]() CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=______________________________。锰的某化合物常做此反应的催化剂,关于此化合物说法正确的是_______(填序号)。
CH3OH (g)+H2O (g)。此反应的平衡常数表达式为K=______________________________。锰的某化合物常做此反应的催化剂,关于此化合物说法正确的是_______(填序号)。
a.可加快该反应速率 b.可增大该反应活化能
c.改变该反应平衡常数 d.提高该反应转化率
(4)向盛有4 mL 0.01mol/L KMnO4酸性溶液中滴入2 mL 0.1mol/L H2C2O4(草酸)溶液,开始颜色变化不明显,一段时间后,颜色变化突然加快,颜色很快消失。分析产生此现象的可能原因____________(填序号)。
a.该反应为放热反应,放出的热量加快反应速率
b.溶液呈酸性,H+ 起催化作用
c.K+ 起催化作用
d.反应产生的Mn2+ 起催化作用
(5)Mn2+催化H2O2分解:2H2O2(l)=2H2O(l)+O2(g) ΔH1,其反应机理如右图示。已知反应Ⅱ为:MnO2(s)+H2O2(1)+2H+(aq)=Mn2+(aq)+O2(g)+2H2O(1) ΔH2。

写出反应 I的热化学方程式(焓变用ΔH1和ΔH2表示):____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com