
【题目】碳化铝可用作甲烷发生剂,实验室欲利用如图所示装置制取甲烷并还原CuO。已知:Al4C3+12H2O=4Al(OH)3+3CH4↑。

回答下列问题:
(1)仪器a的名称是____________。
(2)连接装置并检查气密性后,打开a的活塞和弹簧夹K,一段时间后点燃c和g,d中CuO全部被还原为Cu时,e中固体颜色由白变蓝,f中溶液变浑浊,g处酒精灯火焰呈蓝色。
①e中的试剂是________,其作用是_____________________________。
②实验完毕后,要先熄灭c并继续通入甲烷至d冷却后再熄灭g,原因是_______________。
(3)若最后在g处点燃的气体仅为CH4,则d中发生反应的化学方程式为____________________。
【答案】 分液漏斗 无水硫酸铜 检验产物中是否有水 避免炽热铜粉重新被氧化,且尾气可能含有毒的CO,需要用燃烧法除去 CH4+4CuO![]() 4Cu+2H2O+CO2
4Cu+2H2O+CO2
【解析】(1)仪器a为分液漏斗;
(2)连接装置并检查气密性后,打开a的活塞和弹簧夹K,水滴入烧瓶与Al4C3发生反应,生成CH4,先利用CH4排尽装置中的空气,防止氧气干扰实验。空气排尽后,再点燃c和g,与CuO发生反应。e中固体由白变蓝,则e中为无水硫酸铜,检验水的产生;f中溶液变浑浊,则产生了CO2。实验完毕后,先熄灭c处的酒精灯,继续通入甲烷至d冷却后,再熄灭g,原因是如果立即停止通入甲烷,则炽热的铜粉有可能重新被氧化,实验过程中可能会产生CO,如果立即熄灭g,CO不能有效除去。
故答案为:检验产物中是否有水;避免炽热铜粉重新被氧化,且尾气可能含有毒的CO,需要用燃烧法除去。
(3)若最后在g处点燃的气体仅为CH4,则还原实验中没有产生CO,故产物只有Cu、CO2和H2O。反应方程式为:CH4+4CuO![]() 4Cu+2H2O+CO2。
4Cu+2H2O+CO2。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】下列物质的分类全部正确的是( )
①纯碱 ②食盐水 ③石灰水 ④NaOH ⑤液态氢 ⑥氯酸钾
A. 碱:①④ B. 纯净物:③④⑤ C. 盐:①⑥ D. 混合物:②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的乙醇在氧气不足的情况下燃烧得到CO、CO2和水的总质量为27.6g,若其中水的质量为10.8g,则CO的质量为( )
A.1.4 g
B.2.2 g
C.4.4 g
D.在2.2~4.4 g之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于溶液中的反应:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O,下列措施能使化学反应速率提高的是( )
A.加水
B.增加同浓度FeSO4的用量
C.向溶液中滴加稀硫酸
D.加入少量KMnO4晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读相关信息,结合所学知识,回答下列问题:
(1)铝和锌都是两性金属元素。其氢氧化物都是白色沉淀,既能溶于强酸,又能溶于强碱(生成AlO2-或ZnO22-)。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+。
①写出锌和氢氧化钠溶液反应的化学方程式_________________________________。
②用氨水除去Al(OH)3中的Zn(OH)2的离子方程式为__________________________。
③写出向AlCl3溶液中滴入过量氨水的离子方程式___________________________;
向ZnCl2溶液中逐滴滴入氨水直至过量的现象是___________________________。
④下列各组中的两种溶液,只用胶头滴管和试管即可鉴别的是________________。
A.硫酸铝和氢氧化钠 B.硫酸铝和氨水
C.硫酸锌和氢氧化钠 D.硫酸锌和氨水
(2)Cu2O是一种红色难溶于水的固体,在空气中灼烧Cu2O会生成CuO;Cu2O溶于稀硫酸可生成Cu和Cu2+;Cu2O和Cu都能溶于稀硝酸。
研究性学习小组为检测Cu样品中是否含有Cu2O设计以下实验方案:
方案Ⅰ:取该红色样品溶于足量的稀硝酸中,观察是否有残渣剩余
方案Ⅱ:取该红色样品溶于足量的稀硫酸中,观察溶液颜色变化
方案Ⅲ:称量a g红色样品,在空气中充分灼烧至恒重,得到bg黑色固体。
①比较方案Ⅰ和方案Ⅱ,你认为合理的是方案_________(填“Ⅰ”或“Ⅱ”),合理方案的反应原理为________________________________________(用离子方程式表示)。
②方案Ⅲ中,如果 < b < (用含a的代数式表示)____________,可确认红色粉末含有Cu2O。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了制取纯净干燥的气体A,可用下图所示装置,生成A的速度可通过滴入液体B的速度控制。

①若A是能使带火星的木条复燃的气体,C物质是淡黄色粉末,且不需要Ⅲ装置,则A是______(填化学式),写出烧瓶中发生反应的化学方程式并用双线桥法标出电子得失情况:________________。
②若A可以灭火,C为块状不溶性固体,则A物质是________(填化学式,下同),D物质是__________,烧瓶中发生反应的的离子方程式为_____________________________________。
(2)某学生若用上图所示装置,一次实验即可确定HCl、H2CO3、H2SiO3的酸性强弱(不必选其他酸性物质),则E中发生反应的的离子方程式为__________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I甲、乙、丙、丁分别是由H+、Na+、Al3+、Ba2+、OH-、Cl-、HCO3- 离子中的两种组成,可以发生如图转化:
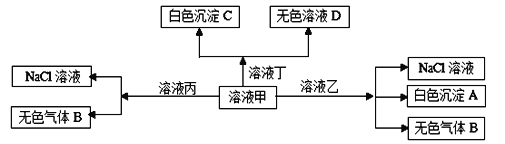
(1)写出无色气体B的一种用途_____________________________。
(2)甲与乙反应的离子方程式为:____________________________。
(3)白色沉淀A可能溶解在溶液D中,其溶解的化学方程式为:________________。
II无水NiCl2在有机合成中有着极为重要的作用,工业上常用含镍原料所制得的NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制得,已知SOCl2能与水反应生成SO2和HCl。写出NiCl2·6H2O在亚硫酰氯(SOCl2)中加热脱水制无水NiCl2的化学方程式___________________________________,NiCl2·6H2O需在亚硫酰氯(SOCl2)中加热脱水的原因是________________________________。
III锰及其化合物用途广泛。锰的化合物有60多种,其中以二氧化锰(MnO2)最稳定。将固体草酸锰(MnC2O4·2H2O)放在一个可以称出质量的容器里加热。固体质量随温度的变化关系如图所示,则:214 ℃时,剩余固体的成分为___________(填化学式); 943 ℃时,剩余固体的成分为__________(填名称)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com