
| A. | 溶液和胶体的本质区别是能否产生丁达尔现象 | |
| B. | FeCl3溶液呈电中性,Fe(OH)3胶体带正电 | |
| C. | 江河入海口处易形成三角洲,这与胶体的性质有关 | |
| D. | 胶体的分散质不能通过滤纸 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的还原剂是Cl- | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| KW/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=5.0×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2可用作呼吸面具中的供氧剂 | |
| B. | 在常温下可用铝制容器贮藏运输浓硫酸 | |
| C. | Al(OH)3可作治疗胃酸过多的一种药剂 | |
| D. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 |
查看答案和解析>>
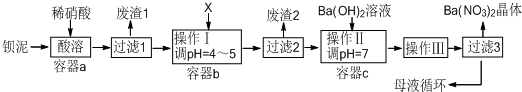
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 制作航天服的聚脂纤维是新型无机非金属材料 | |
| B. | 肥皂可以用来去油污 | |
| C. | 金属的腐蚀属于物理变化 | |
| D. | 煤的气化属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在水中的溶解性:Na2CO3>NaHCO3 | |
| B. | 热稳定性:Na2CO3>NaHCO3 | |
| C. | 相同条件下与同浓度的盐酸反应产生气体的速率:Na2CO3>NaHCO3 | |
| D. | 物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应生成的CO2的量:Na2CO3=NaHCO3. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com