
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_________________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO_____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的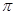 键有________mol。
键有________mol。
(8分)(1)1s22s22p63s23p63d84s2(2分);C(碳)(2分) (2)>(1分) 6(1分)(3)3(2分)
【解析】
试题分析:(1)Ni的原子序数为28,根据构造原理和能量最低原理可写出电子排布式为1s22s22p63s23p63d84s2。第二周期有2个未成对电子的元素是C和O元素,非金属性越强,电负性越大。碳元素的非金属性弱于氧元素,因此电负性较小的是C元素。
(2)Ni2+和Fe2+的离子半径分别为69pm和78pm,离子半径越小,离子键作用力越大,晶体的熔沸点越高,所以熔点NiO>FeO。NaCl中钠离子和氯离子的配位数分别为6,NiO的晶体结构类型与氯化钠的相同,NiO晶胞中Ni和O的配位数分别为6。
(3)单键都是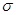 键,双键都是由1个
键,双键都是由1个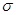 键和1个
键和1个 键构成的,而三键是由1个
键构成的,而三键是由1个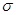 键和2个
键和2个 键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol
键构成的。氮气是由三键构成的,所以1mol氮气分子中含有2mol 键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的
键。若该反应中有4molN-H键断裂,即有1mol肼参加反应,则生成1.5mol氮气,所以形成的 键有1.5mol×3=3mol。
键有1.5mol×3=3mol。
考点:考查核外电子排布、电负性、晶体熔点、晶体结构以及共价键的有关判断和计算等


科目:高中化学 来源: 题型:




查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:同步题 题型:实验题

 H2O+CO2↑+CO↑。用图③加热草酸晶体,验证草酸受热分解及其产物,是原中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图③不合理的地方。 答:____________; 该装置也不符合绿色化学的要求,因为______________。
H2O+CO2↑+CO↑。用图③加热草酸晶体,验证草酸受热分解及其产物,是原中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图③不合理的地方。 答:____________; 该装置也不符合绿色化学的要求,因为______________。 查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
名称 | 分子式 | 颜色、状态 | 溶解性/g | 熔点/℃ | 密度/g·cm-3 |
乙二酸 | H2C2O4 | —— | 8.6(20℃) | 189.5 | 1.900 |
二水合乙二酸 | H2C2O4·2H2O | 无色晶体 | —— | 101.5 | 1.650 |
注:表中“——”表示尚未有具体数据。
回答下列问题:
(1)向盛有Na2CO3粉末的试管里加入约3 mL乙二酸溶液,观察到的现象为_____________;说明乙二酸的酸性比碳酸____________。
(2)向盛有5 mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到现象为_______________________________________________________;说明乙二酸有______________________。
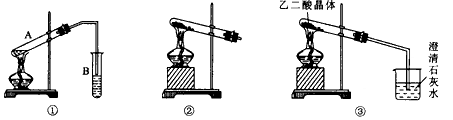
(3)向A试管中加入3 mL乙醇,然后,边振荡试管边加入2 mL 浓硫酸和2 mL乙二酸,按图甲连接好装置,加热3—5 min,在B试管中有油状、香味液体产生。该现象说明发生了______________(填有机反应类型)反应。在B试管中加入饱和Na2CO3溶液的目的是_______________________________________________________________。
导管在液面上的原因是________________________________________________。

(4)图乙是中学化学实验常用的装置,用此装置可制备的气体有___________(填标号)。
A.O2 B.H2 C.Cl2 D.NH3 E.CH2====CH2 F.CH![]() CH
CH
图乙试管口略低于试管底部的原因是_________________________________________。已知草酸分解的化学方程式为H2C2O4![]() H2O+CO2↑+CO↑。用图丙加热草酸晶体,验证草酸受热分解及其产物,图丙是中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图丙不合理的原因。
H2O+CO2↑+CO↑。用图丙加热草酸晶体,验证草酸受热分解及其产物,图丙是中学化学教材中给出的实验装置图,但有人认为该装置不合理。请你根据草酸晶体的某些物理常数和实验目的,指出图丙不合理的原因。
答:______________________________________________________________。
该装置也不符合绿色化学的要求,因为________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com