
| A. | 己烷有4种同分异构体,一定条件下能够发生取代反应 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应属于取代反应 | |
| D. | 聚合物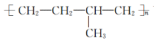 可由单体CH3CH═CH2和CH2═CH2加聚制得 可由单体CH3CH═CH2和CH2═CH2加聚制得 |
分析 A.己烷有五种同分异构体,其碳链结构分别为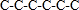 、
、 、
、 、
、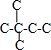 、
、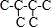 ;
;
B.苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应,均为苯环上H被取代;
C.油脂的皂化反应为水解反应;
D.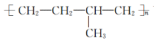 中主链只有C,为加聚产物,由添键段键可知单体.
中主链只有C,为加聚产物,由添键段键可知单体.
解答 解:A.己烷有5种同分异构体,光照条件能够发生取代反应,故A错误;
B.苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应,均为苯环上H被取代,均为取代反应,故B正确;
C.油脂的皂化反应为水解反应,属于取代反应,故C正确;
D.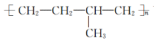 中主链只有C,为加聚产物,由添键段键可知单体为CH3CH═CH2和CH2═CH2,故D正确;
中主链只有C,为加聚产物,由添键段键可知单体为CH3CH═CH2和CH2═CH2,故D正确;
故选A.
点评 本题考查有机物结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意有机反应类型的判断,题目难度不大.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
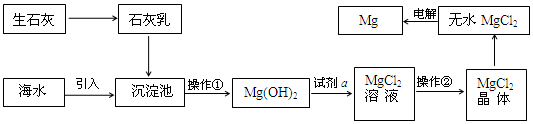
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
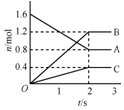 某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).
某温度下,在体积为5L的容器中,A、B、C三种物质物质的量随着时间变化的关系如图所示,则该反应的化学方程式为2A?3B+C,2s内用A的浓度变化的平均反应速率为0.08mol/(L•s).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
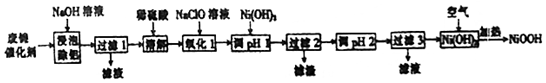
| 开始沉淀的pH | 完全沉淀的pH | |
| Ni2+ | 6.2 | 8.6 |
| Fe2+ | 7.6 | 9.1 |
| Fe3+ | 2.3 | 3.3 |
| Cr2+ | 4.5 | 5.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用溴水除去NaCl溶液中的NaI | |
| B. | 用NaOH溶液与HCl溶液制备NaCl | |
| C. | 用NaOH溶液除去乙酸乙酯中的溴 | |
| D. | 用冷却饱和溶液法提纯含少量NaCl杂质的KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.
海洋是巨大的资源宝库,从海洋中可获得淡水、单质碘、食盐等物质.| 杂质 | CaCl2 | MgCl2 | Na2SO4 |
| 除杂试剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
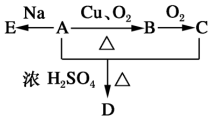 化合物A(C4H10O)是一种有机溶剂,A可以发生如图变化:
化合物A(C4H10O)是一种有机溶剂,A可以发生如图变化:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com