
【题目】在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:![]() 、
、![]() 、
、![]()
B.在含等物质的量的![]() 、
、![]() 、
、![]() 的溶液中加入Zn:
的溶液中加入Zn:![]() 、
、![]() 、
、![]() 、
、![]()
C.在含等物质的量的![]() 、KOH的溶液中通入
、KOH的溶液中通入![]() :
:![]() 、KOH、BaCO3、
、KOH、BaCO3、![]()
D.在含等物质的量的AlO2-、![]() 、
、![]() 溶液中,逐滴加入盐酸:
溶液中,逐滴加入盐酸:![]() 、
、![]() 、AlO2-、
、AlO2-、![]()
【答案】A
【解析】
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2,Cl2具有氧化性,先和还原性强的离子反应,离子的还原性顺序:I->Fe2+>Br-,则反应先后顺序为I-、Fe2+、Br-,故A错误;
B.在含等物质的量的Fe3+、Cu2+、H+的溶液中加入Zn,金属锌先是和氧化性强的离子之间反应,离子的氧化性顺序为:Fe3+>Cu2+>H+>Fe2+,则反应先后顺序为Fe3+、Cu2+、H+,故B正确;
C.在含等物质的量的Ba(OH)2、KOH的溶液中通入CO2,先是和Ba(OH)2反应,其次是KOH,最后与BaCO3反应,则反应先后顺序为:Ba(OH)2、KOH、K2CO3、BaCO3,故C错误;
D、在含等物质的量的AlO2-、OH-、CO32-溶液中,逐滴加入盐酸,OH-优先反应,其次为AlO2-,CO32-最后反应,即反应的先后顺序为OH-、AlO2-、CO32-,故D错误;
故选B。


科目:高中化学 来源: 题型:
【题目】按要求完成填空
(1)计算25 ℃时下列溶液的pH:
①1 mL pH=2的H2SO4加水稀释至100 mL,pH=________;
②0.001 mol/L的盐酸,pH=________;
③0.01 mol/L的NaOH溶液,pH=________;
④0.015 mol/L的硫酸与0.01 mol/L的NaOH等体积混合,混合溶液的pH=________。
(2)H2S溶于水的电离方程式为_______________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿![]() 主要成分为
主要成分为![]() ,还有少量的
,还有少量的![]() 等杂质
等杂质![]() 提取氧化铝作冶炼铝的原料,提取的操作过程如下:
提取氧化铝作冶炼铝的原料,提取的操作过程如下:
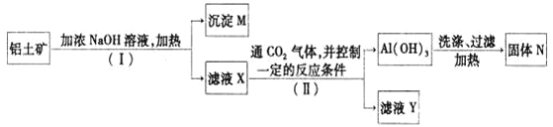
(1)![]() 和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
和II步骤中分离溶液和沉淀的操作为_________,所用到的玻璃仪器是:________;
(2)沉淀M中除含有泥沙外,一定还含有_______,固体N是_______;
(3)滤液X中,含铝元素的溶质的化学式为______,它属于_____![]() 填“酸”、“碱”或“盐”
填“酸”、“碱”或“盐”![]() 类物质;
类物质;
(4)实验室里常往![]() 溶液中加入___________
溶液中加入___________![]() 填“氨水”或“NaOH溶液”
填“氨水”或“NaOH溶液”![]() 来制取
来制取![]() ;
;
(5)将铝粉和氧化铁的混合物点燃,反应放出大量的热量,生成的液态的铁用来焊接铁轨。请写出反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学键的键能是形成(或断开)1 mol 化学键时释放(或吸收)的能量。已知白磷和 P4O6 的分 子结构如图所示:
现提供以下化学键的键能(kJ·mol-1):P—P:198 P—O:360 O==O:498
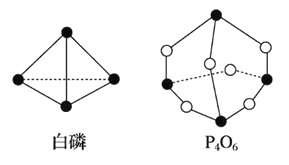
若生成 1 mol P4O6,则反应 P4(白磷)+3O2==P4O6 中的能量变化为
A. 吸收 1638 kJ 能量 B. 放出 1638 kJ 能量
C. 吸收 126 kJ 能量 D. 放出 126 kJ 能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】侯氏制碱原理:NH3+CO2+H2O+NaCl===NaHCO3↓+NH4Cl,需经过制取氨气、制取NaHCO3、分离及干燥NaHCO3四个步骤,下列图示装置能达到实验目的的是( )
A.制取氨气 B.制取NaHCO3
B.制取NaHCO3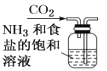
C.分离NaHCO3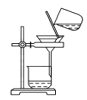 D.干燥NaHCO3
D.干燥NaHCO3 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g)![]() 2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
2NO(g) + O2(g),在体积不变的密闭容器中反应,达到平衡状态的标志是( )
①单位时间内生成n mol O2的同时生成2 n mol NO2
②单位时间内生成n mol O2的同时生成2 n mol NO
③用NO2、NO、O2表示的反应速率数值之比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
A.①④B.②③C.①③④D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向一带活塞的密闭容器中充入2mol![]() 和1mol
和1mol![]() ,发生下列反应:
,发生下列反应:![]() ,达到平衡后改变下述条件,
,达到平衡后改变下述条件,![]() 气体平衡浓度不变的是
气体平衡浓度不变的是![]()
A.保持温度和容器体积不变,充入1mol![]()
B.保持温度和容器内压强不变,充入1mol![]()
C.保持温度和容器体积不变,充入2mol![]() 和1mol
和1mol![]()
D.保持温度和容器内压强不变,充入1mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应A2+B2=2AB的能量变化如下图所示,则下列说法不正确的是( )
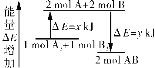
A.该反应是放热反应
B.断裂2 mol A—B键需要吸收![]() kJ的能量
kJ的能量
C.2 mol AB的总能量高于1 mol A2和1 mol B2的总能量
D.断裂1 mol A-A键和1 mol B-B键能吸收![]() kJ的能量
kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g)![]() 2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:
2NH3(g),一种工业合成氨,进而合成尿素的的简易流程图如下:

(1)步骤II中制氢气原理如下:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) CO(g)+H2O(g)
CO(g)+3H2(g) CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
恒容容器中,对于以上反应,能加快反应速率的是_____________。
a. 升高温度 b. 充入He c. 加入催化剂 d. 降低压强
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS,一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式为______________。
(3)CO2和H2在高温、高压、催化剂条件下可合成CH3CH2OH,反应的化学方程式_________________________________。以CH3CH2OH、空气、氢氧化钾溶液为原料,石墨为电极可构成然料电池,该电池中负极上的电极反应式是:_________________________。
(4)已知尿素的结构简式为![]() ,请写出尿素的同分异构体中含有离子键的化学式_________。
,请写出尿素的同分异构体中含有离子键的化学式_________。
(5)已知CO2+ 2NH3![]() CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
CO(NH2)2+ H2O,若合成尿素的流程中转化率为80%时,100吨甲烷为原料能够合成__________吨尿素。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com