
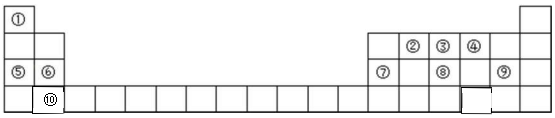
| Ԫ�� | ԭ�ӽṹ������ |
| A | ���γɵ�һ��ͬλ��Ԫ���ڿ����п��Ʋ⻯ʯ����� |
| B | ��Aͬ���ڣ�������������ˮ��������Ũ��ϡ��Һ����ǿ������ |
| C | �ؿ��к�������Ԫ�� |
| D | Dԭ�ӵ�����������������Ӳ�����ͬ���ǵؿ��к������Ľ���Ԫ�� |
| E | �䵥����Ҫ�����ڻ�ɽ�ڸ��� |
| F | �����г����Ľ���������ij����������д��� |
| G | Gԭ����Dԭ��ͬ���ڣ���ԭ�Ӱ뾶��ͬ����Ԫ�������� |
 ��
�� ��
��
���� ��A���γɵ�һ��ͬλ��Ԫ���ڿ����п��Ʋ⻯ʯ��������ж�Ϊ14C��
B��Aͬ���ڣ�������������ˮ��������Ũ��ϡ��Һ����ǿ�����ԣ��ж�ΪNԪ�أ�
C�ؿ��к�������Ԫ��ΪO��
Dԭ�ӵ�����������������Ӳ�����ͬ���ǵؿ��к������Ľ���Ԫ�أ��ж�ΪAl��
E�䵥����Ҫ�����ڻ�ɽ�ڸ�����ΪSԪ�أ�
F�������г����Ľ���������ij����������д����ж�ΪFe��
Gԭ����Dԭ��ͬ���ڣ���ԭ�Ӱ뾶��ͬ����Ԫ��������ΪNa��
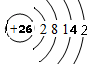
��1������Ԫ�����������ڵ��Ӳ���������������������������F��Fe��ԭ������Ϊ26���ĸ����Ӳ㣬�����2�����ӣ������14�����ӣ�
��2���ȽϷǽ�����ǿ���ľ�������
1��Ԫ�������ڱ��е����λ�ã�
��ͬ����Ԫ�أ��������ң�Ԫ�صķǽ�����������ǿ����F��O��N��C��B��Cl��S��P��S i�ȣ�
��ͬ����Ԫ�����϶��£��ǽ��������μ�������F��Cl��Br��I��O��S��Se��N��P��As�ȣ�
2���ǽ����������������ϵ�Խ���ף��ǽ�����Խǿ��
��F2��Cl2��Br2��I2��H2���������ѣ����Էǽ�����F��Cl��Br��I
3����̬�⻯���Խ�ȶ����ǽ�����Խǿ��
���ȶ��ԣ�HF��H2O��HCl��NH3��HBr��HI��H2S��PH3��
���Էǽ����ԣ�F��O��Cl��N��Br��I��S��P��
4������������Ӧ��ˮ���������Խǿ���ǽ�����Խǿ��
�����ԣ�HClO4��H2SO4��H3PO4��H2CO3��H4SiO4��
��ǽ����ԣ�Cl��S��P��C��Si��
5���ǽ�����ǿ��Ԫ�صĵ������û����ǽ���������Ԫ�صĵ��ʣ�
��2F2+2H2O=4HF+O2����O2+4HCl=2H2O+2Cl2���ؿ�����Cl2����Cl2+2NaBr=2NaCl+Br2��3Cl2+2NH3=N2+6HCl��Cl2+H2S=S+2HCl��
6���ǽ������ʶ�Ӧ�����ӵĻ�ԭ��Խǿ���÷ǽ���Ԫ�صķǽ�����Խ����
���������ӵĻ�ԭ����ǿ������˳����S2-��I-��Br-��Cl-��F-����ǽ�����S��I��Br��Cl��F��
7�����۽�����Ӧʱ���������ʼ�̬Խ�ߣ��ǽ�����Խǿ��
��Cu+Cl2 ��CuCl2��2Cu+S��Cu2S��˵���ǽ�����Cl��S��
8�����ַǽ���ͬ����һ�������У������仯�ϼ��жϷǽ����Ե�ǿ����
��HClO��HClO3�У���Ԫ�������ۡ���Ԫ���Ը��ۣ�˵�����ķǽ�����ǿ���ȣ�
9���������ǽ���Ԫ��ԭ�ӵõ��ӷ��ȣ�����Խ������Խ�ȶ����ǽ���Խǿ��
��3����A��B��C����Ԫ������Ԫ�����γɵ�������������Ŀ֮��Ϊ1��1�����ӻ�������̼����泥���������NaOH��Һ�ڼ���ʱ��Ӧ����̼���ơ�������ˮ��
��4��1molA��ij���⻯���к���14mol���ӣ���Ϊ��Ȳ����Ȳ�ĽṹʽΪH-C��C-H��C��H֮���γ�1�Թ��õ��Ӷԣ�C��C֮���γ�3�Թ��õ��Ӷԣ���֪��25�棬101KPa�£�1g���⻯����������������ȫȼ������Һ̬ˮʱ�ų�������Ϊ40KJ��д�����⻯��ȼ���ȣ�
��1�������ǵ���ɫ���壬�ڢ۷�Ӧ���õ�ͬһ��Һ̬�⻯�ӦΪˮ�����ǵ��ʣ����ΪNa����ΪNa2O2�����Ա�ΪNaOH�������ʳ�����ʳƷ��ҵ����ΪNaHCO3��
Na2O2��ˮ��Ӧ�����������ƺ�������
��2���������ʾ��������ƶ϶�ΪAl��OH��3���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壬˵����Ϊƫ������NaAlO2���ڢ۷�Ӧ��Ҫ��ǿ����Һ���жϼ�ΪAl����ΪAlCl3�������ƶϳ��������жϣ�PH=-lgC��H+�����Ksp[Al��OH��3]=c��Al3+��•c3��OH-�����㣮
��� �⣺��1��A���γɵ�һ��ͬλ��Ԫ���ڿ����п��Ʋ⻯ʯ��������ж�Ϊ14C��̼ԭ�Ӻ�����6�����ӣ�������2�����Ӳ㣬��һ������2�����ӡ����������4�����ӣ���ԭ�ӽṹʾ��ͼΪ ������A��Ԫ�����ڱ��е�λ���ǵڶ����ڣ��ڢ�A�壬F�������г����Ľ���������ij����������д����ж�ΪFe��Fe��ԭ������Ϊ26���ĸ����Ӳ㣬�����2�����ӣ������14�����ӣ�ԭ�ӽṹʾ��ͼ��
������A��Ԫ�����ڱ��е�λ���ǵڶ����ڣ��ڢ�A�壬F�������г����Ľ���������ij����������д����ж�ΪFe��Fe��ԭ������Ϊ26���ĸ����Ӳ㣬�����2�����ӣ������14�����ӣ�ԭ�ӽṹʾ��ͼ�� ��
��
�ʴ�Ϊ���ڶ����ڣ��ڢ�A�壻 ��
��
��2��������ʵ��֤��C��E�ķǽ�����ǿ������֤��O��S�ǽ�����ǿ����
�ٳ����£�C�ĵ��ʳ���̬��E�ĵ��ʳʹ�̬������˵���ǽ�����ǿ�����ʢٴ���
��C����̬�⻯����ȶ���ǿ��E����̬�⻯����ȶ����Ƿǽ�����ǿ�����ж����ݣ��ʢ���ȷ��
��C��E�γɵĻ������У�EΪSԪ�س����ۣ��ʢ���ȷ��
��E���⻯��ķе����C���⻯��ķе㣬�е㲻��˵���ǽ���ǿ�����ʢܴ���
�ʴ�Ϊ���ڢۣ�
��3����A��B��C����Ԫ������Ԫ�����γɵ�������������Ŀ֮��Ϊ1��1�����ӻ�������̼����泥���ѧʽΪ��NH4HCO3��̼�����������NaOH��Һ�ڼ���ʱ��Ӧ����̼���ơ�������ˮ����Ӧ�����ӷ���ʽΪ��NH4++HCO3-+2OH-$\frac{\underline{\;\;��\;\;}}{\;}$CO32-+NH3��+2H2O��
�ʴ�Ϊ��NH4HCO3��NH4++HCO3-+2OH-$\frac{\underline{\;\;��\;\;}}{\;}$CO32-+NH3��+2H2O��
��4��1molA��ij���⻯���к���14mol���ӣ���Ϊ��Ȳ����Ȳ�ĽṹʽΪH-C��C-H��C��H֮���γ�1�Թ��õ��Ӷԣ�C��C֮���γ�3�Թ��õ��Ӷԣ������ʽΪ ��1g����̬��Ȳ��������������ȫȼ������Һ̬ˮʱ�ų�����Ϊ40kJ��ȼ������1mol������ȫȼ���������ȶ��Ļ��������ų�����������ȼ���ȵ��Ȼ�ѧ����ʽΪ��C2H2��g��+$\frac{5}{2}$O2��g��=2CO2��g��+H2O��l����H=��-26��40kJ/mol��=-1040kJ/mol��
��1g����̬��Ȳ��������������ȫȼ������Һ̬ˮʱ�ų�����Ϊ40kJ��ȼ������1mol������ȫȼ���������ȶ��Ļ��������ų�����������ȼ���ȵ��Ȼ�ѧ����ʽΪ��C2H2��g��+$\frac{5}{2}$O2��g��=2CO2��g��+H2O��l����H=��-26��40kJ/mol��=-1040kJ/mol��
�ʴ�Ϊ�� ��1040kJ/mol��
��1040kJ/mol��
��1�������ǵ���ɫ���壬�ڢ۷�Ӧ���õ�ͬһ��Һ̬�⻯�ӦΪˮ�����ΪNa����ΪNa2O2��������������������ӹ��ɣ�����ʽΪ ���Ǻ������Ӽ����ۼ������ӻ������ΪNaOH�������ʳ�����ʳƷ��ҵ����ΪNaHCO3���ҡ���Ϊ�������ƺ�ˮ��Ӧ�����������ƺ�����������ʽΪ��2Na2O2+2H2O=4NaOH+O2����
���Ǻ������Ӽ����ۼ������ӻ������ΪNaOH�������ʳ�����ʳƷ��ҵ����ΪNaHCO3���ҡ���Ϊ�������ƺ�ˮ��Ӧ�����������ƺ�����������ʽΪ��2Na2O2+2H2O=4NaOH+O2����
�ʴ�Ϊ�����Ӽ����ۼ���2Na2O2+2H2O=4NaOH+O2����
��2���������ʾ��������ƶ϶�ΪAl��OH��3���ܷ�Ӧ��ͨ�������һ����������ЧӦ����Ҫ���壬˵����Ϊƫ������NaAlO2���ڢ۷�Ӧ��Ҫ��ǿ����Һ���жϼ�ΪAl����ΪAlCl3����������Ӧ���ӷ���ʽ��AlO2-+2H2O+CO2�TAl��OH��3��+HCO3-��������Ũ��Ϊ1.3��10-6 mol•L-1��Ksp[Al��OH��3]=c��Al3+��•c3��OH-��=1.3��10-33��c��OH-��=$\root{3}{\frac{1.3��1{0}^{-33}}{1.3��1{0}^{-6}}}$=1��10-9mol•L-1��PH=-lgC��H+��=-lgC��10-5��=5��
�ʴ�Ϊ��AlO2-+2H2O+CO2�TAl��OH��3��+HCO3-��5��
���� ���⿼�������ʽṹ�й�֪ʶ������Ԫ���ƶ��Լ�����ת����ϵ��Ӧ�ú�����Ӧ�ã���Ҫ�����Ƽ��仯��������仯�������ʵ��ۺ�Ӧ�ã�ע��Ԫ�������ɵݱ���ɵĸ�Ƶ���㣬��Ŀ�Ѷ��еȣ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
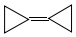 ���������������ĵ��ӽṹһֱ�ܵ����ۻ�ѧ�ҵĹ�ע�����й��ڻ�����滷�����˵��������ǣ�������
���������������ĵ��ӽṹһֱ�ܵ����ۻ�ѧ�ҵĹ�ע�����й��ڻ�����滷�����˵��������ǣ�������| A�� | һ��ȡ������1�� | B�� | �ǻ������ͬϵ�� | ||
| C�� | �뻷����ϩ�� 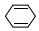 ����ͬ���칹�� ����ͬ���칹�� | D�� | ���е�̼ԭ�Ӿ���ͬһƽ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ƽ����ϵ�м���ˮ��ƽ�������ƶ���c ��H+������ | |
| B�� | ��ˮ���ȣ�Kw����pH���� | |
| C�� | ��ˮ�м��������������ƹ��壬$\frac{c��{H}^{+}��}{c��O{H}^{-}��}$���� | |
| D�� | ��ˮ�м�������NaOH���壬ƽ�������ƶ���c��H+������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | X2Ϊ0.2mol/L | B�� | Y2Ϊ0.2mol/L | C�� | ZΪ0.3mol/L | D�� | ZΪ0.45mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ý����ƻ������ | B�� | �������� | ||
| C�� | ���ú������ | D�� | ���ú˴Ź������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 96g | B�� | 74g | C�� | 82.5g | D�� | ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
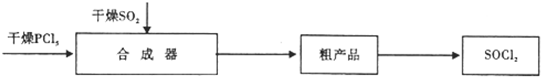
| ʵ�鲽�� | Ԥ������ͽ��� |
| ����1ȡ��������Һ���Թ��еμ�3moL��L-1H2SO4������Һ�����ԣ�Ȼ��������Һ������A��B�Թ��У� | ���������� |
| ����2����A�Թ��еμ���ɫʯ����Һ | ���ȱ�����ɫ��֤����ClO-�������� |
| ����3����B�Թ��еμ�0.01mol•L-1KMnO4��Һ | ���Ϻ�ɫ��ȥ��֤����SO32-�������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
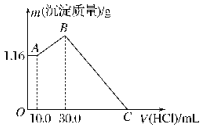 ��NaOH��MgCl2��AlCl3���ֹ�����ɵĻ������������ˮ����1.16g��ɫ����������������Һ����μ���1.00mol•L-1HCl��Һ������HCl��Һ����������ɳ����Ĺ�ϵ��ͼ��ʾ���Իش�
��NaOH��MgCl2��AlCl3���ֹ�����ɵĻ������������ˮ����1.16g��ɫ����������������Һ����μ���1.00mol•L-1HCl��Һ������HCl��Һ����������ɳ����Ĺ�ϵ��ͼ��ʾ���Իش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
�� ��
���鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com