
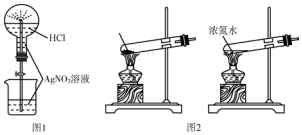
| A. | 用图1所示的装置做喷泉实验时观察到产生白色喷泉 | |
| B. | 如图2所示的两套装置均可制备NH3(不考虑净化和收集) | |
| C. | 称取2.5gCuSO4•5H2O,放入100mL容量瓶中,配制0.10mol•L-1CuSO4溶液 | |
| D. | 除去NaHSO3溶液中的Na2SO3,可加入Ba(OH)2溶液后过滤 |
分析 A.结合氯化氢极易溶于水、且氯化氢与硝酸银溶液反应分析;
B.氢氧化钙和氯化铵反应时,试管口应向下倾斜;
C.容量瓶只能用来配置溶液,不能用来溶解溶质;
D.NaHSO3与Na2SO3都可与Ca(OH)2反应生成沉淀.
解答 解:A.图1中氯化氢易溶于水,且与硝酸银反应生成沉淀,可产生喷泉现象,故A正确;
B.实验室用氢氧化钙和氯化铵在加热制备氨气时,试管口应向下倾斜,故B错误;
C.配制一定物质的量浓度的溶液时,固体或液体不能直接在容量瓶中进行稀释,故C错误;
D.NaHSO3与Na2SO3都可与Ca(OH)2反应生成沉淀,不符合除杂的原则,故D错误;
故选A.
点评 本题综合考查化学实验方案的评价,题目侧重于喷泉实验、氨气的制备、溶液的配制以及除杂等问题,题目难度不大,注意把握相关物质的性质以及化学基本实验操作方法.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
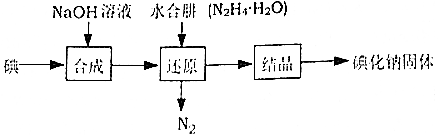
| 规定序号 | 待测体积/mL | 盛装标准滴定管的起点读数/mL | 盛装标准滴定管的终点读数/mL |
| 1 | 25.00 | 0.06 | 24.04 |
| 2 | 25.00 | 0.02 | 24.02 |
| 3 | 25.00 | 0.12 | 24.14 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 结论 |
| A | 配制Fe(NO3)2溶液时加入适量的硝酸 | 抑制Fe2+水解 |
| B | 浓硫酸和蔗糖反应产生的气体通过足量的KMnO4溶液,气体全部被吸收且溶液紫红色褪去 | “黑面包实验”产生的气体具有还原性 |
| C | 往溶液中滴加NaOH溶液,将湿润红色石蕊试纸置于试管口试纸不变蓝 | 原溶液中无NH4+ |
| D | 幼儿使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙 | Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
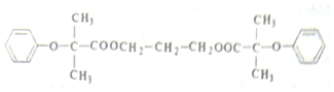
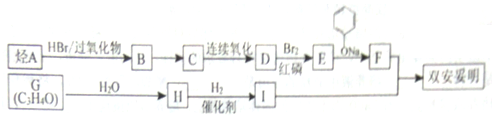
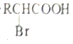 $\stackrel{苯酚钠}{→}$
$\stackrel{苯酚钠}{→}$
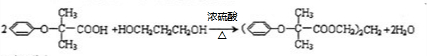 .
.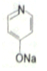 (
( 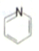 与苯环性质相似)与
与苯环性质相似)与  合成
合成 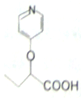 的路线:
的路线: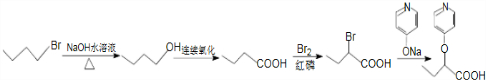 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴被SO2还原为无色的离子 | B. | SO2与Br2化合为一种无色的化合物 | ||
| C. | 反应放热,使溴挥发 | D. | SO2漂白了滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、H+、Cl-、NO3- | B. | Na+、Mg2+、Cl-、SO42- | ||
| C. | K+、Ba2+、OH-、I- | D. | Cu2+、H+、Br-、ClO- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com