
| A、X2YZ3 |
| B、X2YZ4 |
| C、XYZ4 |
| D、XYZ3 |


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,1 mol氦气含有的核外电子数为4 nA |
| B、一定条件下,0.1mol铁与0.1mol Cl2充分反应,转移的电子数约为0.3 nA |
| C、标准状况下,11.2L以任意比例混合的氮气和氧气所含的原子数为nA |
| D、0.1 mol/L的BaCl2溶液中Cl-数为0.2nA |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、TNT的结构简式为: |
B、苯乙醛的结构简式为: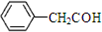 |
C、丙烷分子的球棍模型为: |
| D、乙烯的结构简式为:CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH相等的①CH3COONa ②Na2CO3 ③C6H5ONa ④NaOH溶液的物质的量浓度大小:①>②>③>④ |
| B、氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) |
| C、Na2CO3、NaHCO3的混合溶液,其浓度均为0.1 mol?L-1:2c(Na+)=3[c(CO32-)+c(HCO3-)+c(H2CO3)] |
| D、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)=c(NH4+)>c(Fe2+)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向NH4HCO3溶液中加入过量烧碱溶液:NH4++OH-═NH3↑+H2O | ||||
| B、将CO2通入到纯碱饱和溶液中:2Na++CO32-+CO2+H2O═2NaHCO3↓ | ||||
| C、向Ba(OH)2溶液中加入足量的KHSO4溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | ||||
D、将饱和FeCl3溶液滴入沸水中制胶体:Fe3++3H2O
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、略升高温度,溶液的pH值增大 |
| B、2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C、c(Na+)+c(H+)=2 c(CO32-)+2c(HCO3-)+c(OH-) |
| D、加入少量NaOH固体,c(CO32-)与c(Na+)均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+) |
| c(NH3?H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com