
【题目】下图表示氮及其化合物在一定条件下的转化关系:
(1)反应I:N2(g)+3H2(g)![]() 2NH3(g) ΔH=–92 kJmol-1
2NH3(g) ΔH=–92 kJmol-1
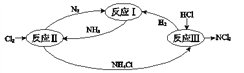
下左图是反应I中平衡混合气中NH3的体积分数随温度或压强变化的曲线,图中L(L1、L2)、X分别代表温度或压强。其中X代表的是________(填“温度”或“压强”)。
(2)①反应II的化学方程式是_________________________。
②反应II其中一步反应为2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462 kJmol-1
已知:N2(g)![]() 2N(g) Cl2(g)
2N(g) Cl2(g)![]() 2Cl(g)
2Cl(g)
断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为________kJ。
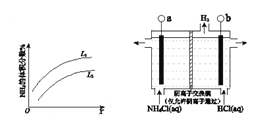
(3)反应III是利用上图所示装置电解制备NCl3(氯的化合价为+1),其原理是:NH4Cl+2HCl![]() NCl3 +3H2↑。
NCl3 +3H2↑。
①b接电源的_______极(填“正”或“负”)。② 阳极反应式是___________________。
(4)反应III得到的NCl3可以和NaClO2制备 ClO2,同时生成NH3,该反应的离子方程式是________。
【答案】 压强 8NH3+3Cl2=N2+6NH4Cl 41 负 3Cl--6e-+NH4+=NCl3+4H+ NCl3+6ClO2-+3H2O=6ClO2+NH3+3C1-+3OH-
【解析】(1)由图像得出:随着X的增大,氨气的体积分数应该增大。升高温度,平衡向逆反应方向移动,氨气的体积分数应该减小,所以X不可能代表温度。增大压强,平衡向正反应方向移动,氨气的体积分数增大,所以X应该代表压强。
(2)①根据转化关系可以判断,反应物为![]() 和
和![]() ,生成物为
,生成物为![]() 和
和![]() ,然后根据得失电子守恒和原子守恒配平,化学方程式为
,然后根据得失电子守恒和原子守恒配平,化学方程式为![]() 。
。
②化学反应的过程是旧化学键断裂(吸收能量)和新化学键形成(放出能量)的过程,设断开1 mol H–N键吸收a kJ能量,断开1 mol H–Cl键吸收b kJ能量,根据化学反应2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462 kJmol-1,得到6×a+3×243-945-6×b=-462,得![]() ,所以断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为41kJ。
,所以断开1 mol H–N键与断开1 mol H–Cl键所需能量相差约为41kJ。
(3)①b电极的反应为H+得电子生成氢气,发生还原反应,所以b电极为阴极,连接电源的负极。
②阳极反应物为NH4Cl,生成物为NCl3 ,题目中给出氯的化合价为+1价,所以氯失去电子,化合价升高,氮、氢不变价,然后根据电荷守恒配平方程式,则阳极反应式是![]()
(4)根据题意,![]() 可以和
可以和![]() 制备
制备![]() ,同时生成
,同时生成![]() ,反应物为
,反应物为![]() ,生成物为
,生成物为![]() ,根据化合价升降相等、电荷守恒和原子守恒配平,该反应的离子方程式是NCl3+6ClO2-+3H2O=6ClO2+NH3↑+3C1-+3OH- 。
,根据化合价升降相等、电荷守恒和原子守恒配平,该反应的离子方程式是NCl3+6ClO2-+3H2O=6ClO2+NH3↑+3C1-+3OH- 。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】R2O82-离子在一定条件下可以把Mn2+离子氧化,若反应后R2O82-离子变为RO42-离子,又知反应中氧化剂和还原剂的物质的量之比为5︰2,Mn2+离子被氧化后的化合价为
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1molL-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是

A. 由X、Y、Z、W四种元素组成的盐溶液pH小于7
B. 化合物F中含有共价键和离子键
C. 0.1molB与足量C完全反应共转移电子数为0.2NA
D. Z元素的最高正价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2广泛用于造纸工业、污水处理等,其漂白能力是漂白粉的4~5倍,工业上用C1O2气体制NaClO2的工艺流程如下:

己知:NaClO2饱和溶液在低于38℃时析出NaC1O2·3H2O,高于38℃时析出NaClO2
下列说法不正确的是
A. 吸收器中生成NaClO2的离子方程式:2ClO2+2OH-+H2O2=2ClO2-+O2+2H2O
B. 流程中的结晶、过滤操作应该是蒸发结晶、趁热过滤
C. 提高吸收器中的反应温度可以提高反应速率,也提高反应物的利用率
D. 发生器中反应结束后,向其中通入一定量空气的目的是驱赶出ClO2,使其被充分吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g)+Y(g) ![]() 3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )
3Z(g) ,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是( )

A. Q点时,Y的转化率最大
B. W点X的正反应速率等于M点X的正反应速率
C. 升高温度,平衡常数增大
D. 温度一定,平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下 10mL0.1mol/L 的醋酸溶液加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.溶液中 ![]() 不变
不变
C.醋酸的电离程度增大,c(H+ )也增大
D.再加入 10mL0.1mol/L 的 NaOH 溶液,混合液的 pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:
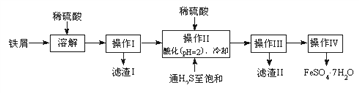
查询资料,得有关物质的数据如下表:
25℃时 | 饱和H2S溶液 | SnS沉淀完全 | FeS开始沉淀 | FeS沉淀完全 |
pH值 | 3.9 | 1.6 | 3.0 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为____________________。
A.KSCN溶液B.NaOH溶液C.KMnO4溶液
(2)操作II中,通入硫化氢至饱和的目的是(写两点)___________、____________。
(3)操作IV的顺序依次为________、冷却结晶、过滤。
(4)测定绿矾产品中Fe2+含量的方法是:
a.称取3.72g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01000mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
①滴定时盛放KMnO4溶液的仪器为_________(填仪器名称)。
②计算上述样品中FeSO47H2O的质量分数为__________。
③上述测定中,若滴定管规格为50mL,则步骤a中称取样品的质量不能超过______g。(保留4位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图1中氮元素及其化合物的转化关系,回答问题:
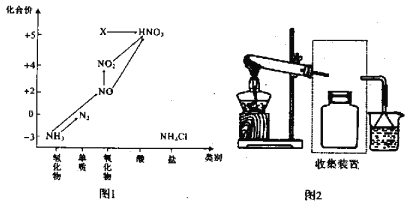
(1)实验室常用NH4Cl与Ca(OH)2制取氨气,该反应的化学方程式为____________________。
(2)若要收集一瓶氨气,请将下列装置补充完整,在图2虚框内画出连接图。____________
(3)下列试剂可用于干燥NH3的是________________________________。
A.浓硫酸 B.碱石灰 C.CuSO4固体 D.P2O5
(4)工业上以NH3、空气、水为原料生产硝酸分为三步:
①NH3→NO化学方程式为________________________________;
②NO→NO2实验现象是________________________________;
③将32.64g铜与l40mL一定浓度的HNO3反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2L。则其中NO、NO2的物质的量比为____________________。
(5)图1中在标准状况下将NO2、NO、O2混合并充满容器,将该容器倒置于水中,气体完全溶解,无气体剩余,若产物也不扩散,则所得溶液的物质的量浓度M,其数值大小范围为___________
A.0<M<l/22.4 B. 1/39.2<M<1/22.4 C.1/39.2<M<1/28 D.1/28<M<1/22.4
(6)图1中X转化为HNO3的化学方程式为:________________________________。
(7)若要将NH3→N2,从原理上看,下列试剂可行的是_______________。
A.O2 B.Na C.NH4Cl D. NO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组按如下实验流程探究海带中碘含量的测定和碘的制取。
实验(一) 碘含量的测定
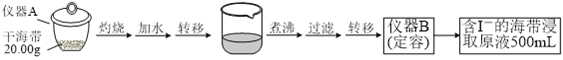
取0.0100 mol·Lˉ1的AgNO3标准溶液装入滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
实验(二) 碘的制取
另制海带浸取原液,甲、乙两种实验方案如下:
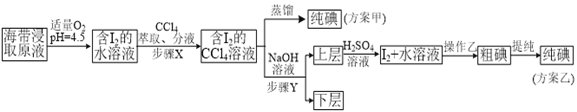
已知:3I2+6NaOH=5NaI+NaIO3+3H2O。
请回答:
(1)实验(一) 中的仪器名称:仪器A_________, 仪器 B___________________。
(2)该次滴定终点时用去AgNO3溶液的体积为20.00mL,计算得海带中碘的百分含量为_______%。
(3)①分液漏斗使用前须检漏,检漏方法为___________________。
②步骤X中,萃取后分液漏斗内观察到的现象是_______________。
③下列有关步骤Y的说法,正确的是___________________。
A.应控制NaOH溶液的浓度和体积 B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质 D.NaOH溶液可以由乙醇代替
④实验(二) 中操作Z的名称是______________________。
(4)方案甲中采用蒸馏不合理,理由是_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com