
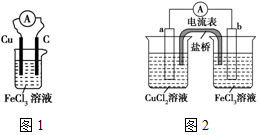
 实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.
实验室有如下材料:铜片、铁片、石墨棒、CuCl2溶液、FeCl3溶液、导线、电流表、盐桥(装有琼脂-KCl的U形管)、烧杯等.甲同学设计了如图1的原电池装置,但乙同学发现甲同学设计的原电池装置效率不高,电流在短时间内就会衰减,为解决以上问题,将原电池设计成了带盐桥的装置,如图2所示.分析 (1)①常温下属于氧化还原反应的放热反应,可设计为原电池,存在元素化合价变化的反应为氧化还原反应;
②铁比铜活泼,所以铁是负极,铜是正极,电极反应式为:2FeCl3+Fe=3FeCl2;
③铜与铁离子发生自发的氧化还原反应,所以图2中a是铜,b是石墨棒,负极是铜失电子发生氧化反应,正极是铁离子发生还原反应;
(2)a.实验过程中,左侧烧杯铜放电生成铜离子,所以盐桥中Cl-向左移动,导致氯离子浓度变大;
b.实验过程中取出盐桥,不能构成闭合回路;
c.电子不能通电解质溶液,而是经过外电路.
解答 解:(1)①a.C(s)+H2O(g)═CO(g)+H2(g)△H>0为氧化还原反应,但为吸热反应,不能设计为原电池,故错误;
b.2H2(g)+O2(g)═2H2O(l)△H<0为氧化还原反应,为放热反应,能设计为原电池,故正确;
c.NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H<0,不属于氧化还原反应,不能设计为原电池,故错误;
故选:b;
②铁比铜活泼,所以铁是负极,铜是正极,电极反应式为:2FeCl3+Fe=3FeCl2,故答案为:2FeCl3+Fe=3FeCl2;
③铜与铁离子发生自发的氧化还原反应,所以图2中a是铜,b是石墨棒,负极是铜失电子发生氧化反应,电极反应式为:Cu-2e-=Cu2+,正极是铁离子发生还原反应,电极反应式为:2Fe3++2e-=2Fe2+,
故答案为:铜片;石墨棒;Cu-2e-=Cu2+;2Fe3++2e-=2Fe2+;
(2)a.实验过程中,左侧烧杯铜放电生成铜离子,所以盐桥中Cl-向左移动,导致氯离子浓度变大,故正确;
b.实验过程中取出盐桥,不能构成闭合回路,所以原电池不能继续工作,故正确;
c.电子不能通电解质溶液,而是经过外电路,故错误;
故选:c.
点评 本题考查了原电池原理和设计,明确正负极的判断、电子的流向、盐桥中阴阳离子的移动方向即可解答,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 混合气体通过盛有酸性高锰酸钾溶液的洗气瓶 | |
| B. | 混合气体通过盛有足量溴水的洗气瓶 | |
| C. | 混合气体通过盛水的洗气瓶 | |
| D. | 混合气体与氢气混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
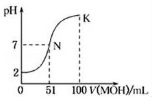 常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )
常温下,向100mL 0.01mol•L-1HA溶液中逐滴加入0.02mol•L-1的MOH溶液,图中所示曲线表示混合溶液的pH变化情况,下列说法不正确的是( )| A. | HA为一元强酸,MOH为一元弱碱 | |
| B. | N点溶液中离子浓度大小关系为:c(M+)=c(A-)>c(H+)=c(OH-) | |
| C. | N点水的电离程度大于K点水的电离程度 | |
| D. | N→k之间曲线上任意一点都有c(M+)>c(OH-)>c(A-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盛放碱液的试剂瓶不用玻璃塞;SiO2+2OH-═SiO32-+H2O | |
| B. | 配制FeCl3溶液时要加盐酸:Fe3++3H2O?Fe(OH)3+3H+ | |
| C. | 制Cl2时用排饱和氯化钠溶液收集气体:H2O+Cl2?Cl-+H++HClO | |
| D. | 金属钠燃烧时,火焰呈黄色:2Na+O2 $\frac{\underline{\;点燃\;}}{\;}$Na2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验内容 | 实验现象 | 相关解释 | |
| A | 等量的Cu分别与等体积足量的浓硝酸和稀硝酸反应 | 浓硝酸反应后呈绿色,稀硝酸反应后呈蓝色 | c(Cu2+)不同 |
| B | NH3与Cl2混合 | 生成白烟 | NH3与Cl2发生化合反应生成NH4Cl |
| C | 往Fe(OH)3胶体中逐滴滴入稀盐酸 | 先出现红褐色沉淀,后沉淀溶解 | 先胶体聚沉,后Fe(OH)3溶解 |
| D | 加热硝酸铜固体,将带火星的木条伸入所得的气体中 | 生成红棕色气体,带火星木条复燃 | 2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑有氧气生成,不能说明NO2有助燃性. |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=2与pH=1的CH3COOH溶液中c(H+)之比为1:10 | |
| B. | 100℃时,纯水中c(H +)=1×10-6 mol•L-1,此时纯水显酸性 | |
| C. | 等体积pH=12 NaOH溶液和pH=2 CH3COOH溶液混合,混合后溶液pH>7 | |
| D. | 1mol/L醋酸溶液加水稀释,溶液中所有离子浓度均减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com