
 ��CO2�ĽṹʽΪO=C=O��
��CO2�ĽṹʽΪO=C=O������ ��1����K2S�����ӻ���������Ӻͼ������γ����Ӽ����ݴ�д������ʽ��C02��ֱ���η��ӣ�̼ԭ����2����ԭ�Ӷ��γ�˫�����ݴ�д���ṹʽ��
��S����ˮ��Ӧ����������ǿ�ᣬ��֪��Ϊ��������ᣬȻ����ƽ��
��2������NH3+H2O?NH4++OH-������������ˮ�ʼ��Ե����ӷ���ʽ��
��3���ȸ��������غ�ȷ��������������Ȼ�������ԭ�ӡ���ԭ�ӵ����ʵ��������ߵ����ʵ���֮�ȣ�ȷ��������ķ���ʽ�������д��ѧ����ʽ��
��� �⣺��1�����������ӻ���������Ӻͼ������γ����Ӽ����صĵ���ʽΪ�� C02��ֱ���η��ӣ�̼ԭ����2����ԭ�Ӷ��γ�˫�����ṹʽΪO=C=O���ʴ�Ϊ��
C02��ֱ���η��ӣ�̼ԭ����2����ԭ�Ӷ��γ�˫�����ṹʽΪO=C=O���ʴ�Ϊ�� �� O=C=O��
�� O=C=O��
��S����ˮ��Ӧ��������������ᣬ��Ӧ�����ӷ���ʽΪ��3Cl2+S+4H2O=8H++SO42-+6Cl-��
�ʴ�Ϊ��3Cl2+S+4H2O=8H++SO42-+6Cl-��
��2��������ˮ�ķ�ӦΪ��NH3+H2O?NH4++OH-���£�N2H4������ˮ�Լ��ԣ���ԭ���백���ƣ����ӷ���ʽΪ��N2H4+H2O?NH2NH3++OH-��
�ʴ�Ϊ��N2H4+H2O?NH2NH3++OH-��
��3��86g�û����ﱬը�ֽ�����ɱ����N2 67.2L����һ�����嵥��H2��N2�����ʵ���Ϊ$\frac{67.2L}{22.4L/mol}$=3mol������Ϊ3mol��28g/mol=84g��������������Ϊ86g-84g=2g�����ʵ���Ϊ1mol����ԭ�ӡ���ԭ�ӵ����ʵ����ֱ�Ϊ6mol��2mol�����ߵ����ʵ���֮��Ϊ3��1������������ķ���ʽΪHN3����ѧ����ʽΪ��2HN3$\frac{\underline{\;��ը\;}}{\;}$3N2+H2��
�ʴ�Ϊ��2HN3$\frac{\underline{\;��ը\;}}{\;}$3N2+H2��
���� ���⿼���˺�����������ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ��漰֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ�����ѧ��������Ϣ������⡢���������������֪ʶ��Ǩ��������������


 ������ҵ��ͬ����ϰ��ϵ�д�
������ҵ��ͬ����ϰ��ϵ�д� С��ſ�ʱ��ҵϵ�д�
С��ſ�ʱ��ҵϵ�д� һ������ϵ�д�
һ������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
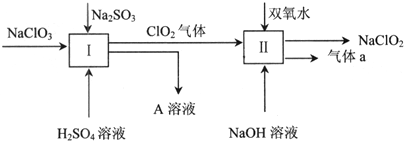
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
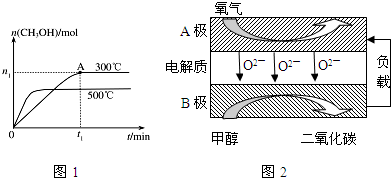
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢ� | B�� | �ۢݢ� | C�� | �ܢ� | D�� | �ڢۢݢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | ���� | ���� | |
| A | ��ij��Һ�еμ�ϡNaOH��Һ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ� | ��ֽ������ | ԭ��Һ����NH4+ |
| B | ��ij��ɫ��Һ�еμ���ˮ��CCl4�������� | �²���Һ����ɫ | ԭ��Һ����I- |
| C | �ýྻ��˿պȡij��Һ������ɫ��Ӧ | ����ʻ�ɫ | ��Һ����K+ |
| D | ��ij����ͨ��Ʒ����Һ�� | Ʒ����Һ��ɫ | ������һ����SO2 |
| A�� | A | B�� | B | C�� | C | D�� | D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 3��2��2��4 | B�� | 1��1��1��1 | C�� | 2��1��1��2 | D�� | 1��2��1��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ�ȼ��飨CH3Cl�� | B�� | ����-CH3 �� | C�� | ̼�����ӣ�CH3-�� | D�� | ��ϩ��C2H4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com