
向体积都为1L,pH都等于2的盐酸和醋酸溶液中投入0.65gZn,则下图中比较符合客观事实的曲线是


科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(文)试卷(解析版) 题型:?????
欲配制100ml 0.10mol/L的KCl溶液,需要使用的仪器有
A.玻璃棒 B.烧杯 C.分液漏斗 D.100ml容量瓶
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(文)试卷(解析版) 题型:?????
烧碱的化学式为
A.NaCl B.NaOH C.NaHCO3 D.Na2CO3
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(文)试卷(解析版) 题型:?????
下列制取硝酸铜的方法符合“绿色化学”理念的是
A.铜和稀硝酸反应 B.铜和硝酸铁反应
C.氧化铜和稀硝酸反应 D.铜和浓硝酸反应
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(理)试卷(解析版) 题型:填空题
(10分)经测定某溶液中只含Na+、CH3COO—、H+、OH—四种离子,已知该溶液中含有一种或两种溶质。查资料表明等物质的量浓度的醋酸和醋酸钠等体积混合后溶液呈酸性,试完成下列各题。
(1)试推测能组成这种溶液的可能的溶质或组合是 ;(用化学式表示)
(2)有关这种溶液,下列说法不正确的是( )
A.若溶液中离子间满足c(CH3COO—)>c(Na+)>c(H+)>c(OH—),则溶液中溶质一定为CH3COOH和CH3COONa
B.若溶液中离子间满足c(Na+)>c(CH3COO—)>c(OH—)>c(H+),则溶液中溶质一定只有CH3COONa
C.若溶液中c(Na+)= c(CH3COO—),则该溶液一定呈中性
D.若溶液中c(CH3COOH)>c(Na+),则溶液一定呈酸性
(3)若溶液是由体积相等的醋酸溶液和氢氧化钠溶液混合而成,而且恰好呈中性,则混合前
c(CH3COOH) c(NaOH)(填“大于”、“小于”或“等于”),混合前两溶液中分别的
c(H+) c(OH—)(同上);
(4)若溶液为等体积、等物质的量浓度的醋酸和醋酸钠溶液混合而成,则混合后溶液中的离子浓度关系正确的是 。
A.c(CH3COO—) + c(OH—) = c(Na+)+ c(H+)
B.c(CH3COO—)+ 2c(OH—)= c(CH3COOH)+2 c(H+)
C.c(Na+)>c(CH3COO—)>c(H+)>c(OH—)
D.2c(Na+)= c(CH3COOH)+ c(CH3COO—)
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(理)试卷(解析版) 题型:选择题
下列在指定溶液中的各组离子,一定能够大量共存的是
A.无色溶液中:HCO3—、Al3+、Cl—、NO3—
B.pH=11的溶液中:S2—、K+、CO32—、Cl—
C.pH=1的溶液中:Fe2+、NH4+、Mg2+、NO3—
D.水电离的c(H+) = 10—12 mol/L的溶液中:Fe3+、SO42—、K+、Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015广东省汕头市高二上学期月考化学(理)试卷(解析版) 题型:选择题
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化
A.V1>V2 B.V1<V2 C.V1=V2 D.V1≤V2
查看答案和解析>>
科目:高中化学 来源:2014-2015福建省厦门市高三上学期期末质量检查化学试卷(解析版) 题型:选择题
短周期元素T、Q、R、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族族序数相等。它们的最高价氧化物的水化物依次为甲、乙、丙、丁。下列叙述不正确的是
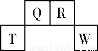
A.R的氧化物在空气中与其它物质作用可形成光化学烟雾
B.常温下丁的浓溶液可用T单质所制的容器来盛装
C.丁的浓溶液与Q的单质加热发生反应,可生成体积比为1:2的两种气体
D.甲、乙、丙、丁受热均易分解
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市高二上学期期中考试化学(理)试卷(解析版) 题型:填空题
(10分)硫酸工业中SO2转化为SO3是重要的反应之一,在一定压强和催化剂作用下在2L密闭容器中充入0.8molSO2和2molO2发生反应:2SO2(g)+O2(g) 2SO3(g),SO2的转化率随温度的变化如下表所示:
2SO3(g),SO2的转化率随温度的变化如下表所示:
温度(℃) 450 500 550 600
SO2的转化率(%) 97.5 95.8 90.50 80.0
(1)由表中数据判断?H 0(填“>”、“=”或“<”)。
(2)能判断该反应已达到平衡状态的依据是 (填序号)。
a.混合气体中各组分的质量不变
b.c(SO2)=c(SO3)
c.v正(SO3)=2v逆(O2)
(3)某温度下经2min反应达到平衡后c(SO2)=0.08mol/L,则:
①0~2min之间,O2的平均反应速率是 。②此时的温度是 ℃。
③此温度下的平衡常数K= (可用分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com