
| A、由于Ksp(BaSO4)=1.1×10-10小于Ksp(BaCO3)=5.1×10-9,则不能使BaSO4沉淀转化为BaCO3沉淀 |
| B、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的最高温度作为末温度 |
| C、除去CH3COOC2H5中的CH3COOH先加足量的饱和Na2CO3溶液再蒸馏 |
| D、能使湿润的KI淀粉试纸变蓝的气体一定是Cl2 |


科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
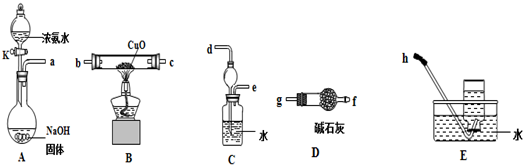
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | HF | H3PO4 |
| 电离平衡常数 | K=3.6×10-4 | 7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
| A、在等浓度的NaF、NaH2PO4混合溶液中,c(Na+)+c(H+)=c(F-)+c(H2PO4-)+c(OH-) |
| B、少量H3PO4和NaF反应的离子方程式为:H3PO4+F-=H2PO4-+HF |
| C、同温同浓度时,溶液的pH:NaF>NaH2PO4>Na2HPO4 |
| D、结合H+的能力:F->HPO42->PO43- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 13 |
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 总压强p/100kPa | 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
| 反应时间t/h | 0 | 4 | 8 | 16 |
| C(A)/(mol?L-1) | 0.100 | 0.0508 | 0.0254 | 0.00635 |
查看答案和解析>>
科目:高中化学 来源: 题型:
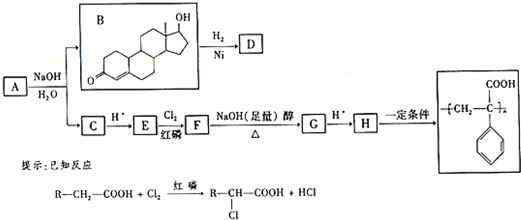
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30% | B、35% |
| C、65% | D、70% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com