
| 选项 | 实验操作或事实 | 实验目的或结论 |
| A | 淡黄色试液$\stackrel{NaOH溶液}{→}$红褐色沉淀 | 说明原溶液中一定含有FeCl3 |
| B | 白色Mg(OH)2 $\stackrel{CuSO_{4}溶液}{→}$蓝色Cu(OH)2 | Mg(OH)2的溶度积大于Cu(OH)2 |
| C | 新收集的酸雨$\stackrel{Ba(NO_{3})_{2}溶液}{→}$白色沉淀 | 酸雨中一定含有SO42- |
| D | H3PO3+2HaOH(足量)═Na2HPO2+2H2O | H3PO3属于三元酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.红褐色沉淀为氢氧化铁,但淡黄色试液一定含铁离子,可能含亚铁离子;
B.沉淀向溶度积小的方向转化;
C.新收集的酸雨含亚硫酸,与硝酸钡发生氧化还原反应生成硫酸钡;
D.NaOH足量,生成的Na2HPO3为正盐.
解答 解:A.红褐色沉淀为氢氧化铁,但淡黄色试液可能含亚铁离子和铁离子,则原溶液中不一定含所有FeCl3,故A错误;
B.白色Mg(OH)2 转化为蓝色Cu(OH)2,说明Mg(OH)2的溶度积大于Cu(OH)2,故B正确;
C.新收集的酸雨含亚硫酸,与硝酸钡发生氧化还原反应生成硫酸钡,不能说明是否含SO42-,故C错误;
D.NaOH足量,生成的Na2HPO3为正盐,则H3PO3属于二元酸,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及离子检验、沉淀转化、氧化还原反应等,把握物质的性质、发生的反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
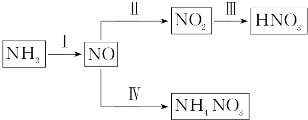
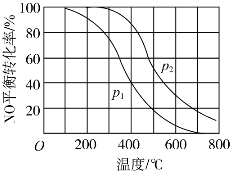
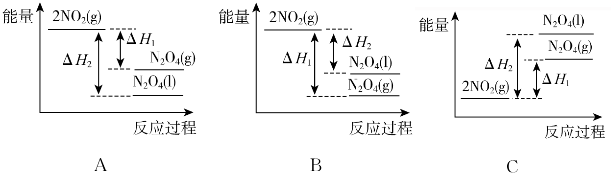
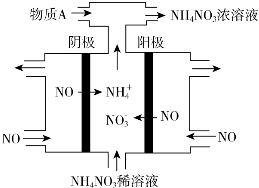
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Y2-的还原性大于Z? | B. | 单质的还原性Z>Y | ||
| C. | b一定小于c | D. | X、Y可处于同周期或X在Y的下周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
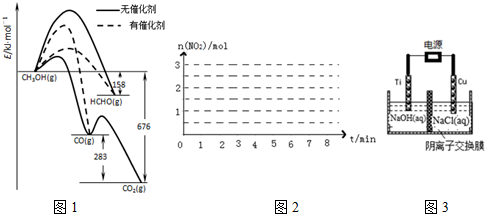
| 物质的量/mol 时间 | n (N2H4) | n (NO2) | n (N2) |
| 起始 | 2.0 | 3.0 | 0 |
| 第2min | 1.5 | a | 0.75 |
| 第4min | 1.2 | b | 1.2 |
| 第6min | 1.0 | c | 1.5 |
| 第7min | 1.0 | c | 1.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将PH=1的醋酸和PH=13的Na OH溶液混合后,若c(CH3COO-)=c(Na+),则溶液显中性 | |
| B. | 在Na2SO3溶液中:c(Na+)=2c(SO32-)+c(HSO3-)+c(OH-) | |
| C. | pH=6的CH3COOH溶液和pH=6的NH4Cl溶液,由水电离出的c(H+)均为1×10-8mol•L-1 | |
| D. | 在饱和Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com