
| A. | 1 mol NH3所含有的原子数为NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48 g O3所含的氧原子数为3NA | |
| D. | 0.1 molNa+中所含的电子为1.1NA |
分析 A.1个氨气分子含有4个原子;
B.常温常压Vm不等于22.4L/mol;
C.依据n=$\frac{m}{M}$=$\frac{N}{N{\;}_{A}}$计算解答;
D.1个钠离子含有10个电子.
解答 解:A.1个氨气分子含有4个原子,所以1 mol NH3所含有的原子数为4NA,故A错误;
B.常温常压Vm不等于22.4L/mol,Vm未知,无法计算氧气的物质的量,无法计算氧原子个数,故B错误;
C.臭氧是由氧原子构成,则48 g O3所含的氧原子数为$\frac{48g}{16g/mol}$×NA=3NA,故C正确;
D.0.1 molNa+中所含的电子为NA,故D错误;
故选:C.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,注意气体摩尔体积实验条件和对象.


 每课必练系列答案
每课必练系列答案 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源: 题型:推断题
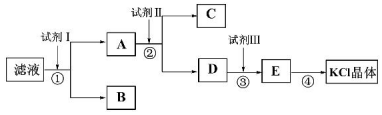
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | K+、Na+、ClO-、SO42- | 少量SO2 | SO2+ClO-+H2O═SO42-+Cl-+2H+ |
| B | NH4+、Fe3+、Br-、SO42- | 过量H2S | 2Fe3++H2S═2Fe2++S↓+2H+ |
| C | NH4+、Na+、Fe3+、AlO2- | 过量铜粉 | 2Fe3++Cu═2Fe2++Cu2+ |
| D | K+、Na+、HCO3-、AlO2- | 少量HCl | H++AlO2-+H2O═Al(OH)3↓ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
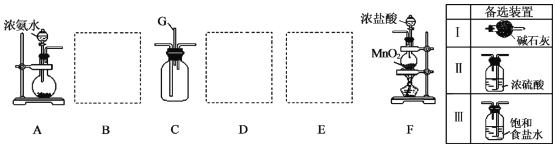
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
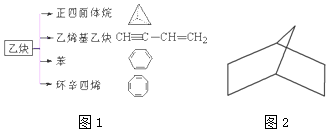
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒 | |
| D. | 在标准状况下,2.24L苯中所含分子数约为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
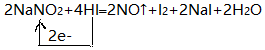 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
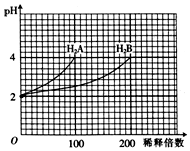 常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )
常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( )| A. | H2A的电离方程式为H2A?H++HA-、HA-?H++A2- | |
| B. | pH=4的NaHA水溶液中:c(Na+)>c(HA-)>c(A2-)>c(H2A)>c(OH-) | |
| C. | 含NaHA、NaHB的混合溶液中,各离子浓度关系为c(Na+)=c(A2-)+c(HB-)+c(H2B)+c(B2-) | |
| D. | NaHB水溶液中,各离子浓度的大小顺序为c(Na+)>c(HB-)>c(OH-)>c(H+)>c(B2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com