
| A、v(H2)=0.3 mol?L-1?min-1 |
| B、v(N2)=0.2 mol?L-1?min-1 |
| C、v(NH3)=0.25 mol?L-1?min-1 |
| D、v(H2)=0.4 mol?L-1?min-1 |


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:


 .请设计以
.请设计以 和
和 为原料合成化合物
为原料合成化合物 的实验方案.(用合成路线流程图表示为:A
的实验方案.(用合成路线流程图表示为:A| 反应试剂 |
| 反应条件 |
| 反应试剂 |
| 反应条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,其合成路线如下:
,其合成路线如下:
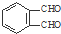 和足量的H2反应,最多可消耗H2
和足量的H2反应,最多可消耗H2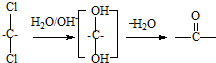 的反应得到
的反应得到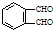 ,请写出该同分异构体的结构简式:
,请写出该同分异构体的结构简式:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入足量稀HNO3酸化的AgNO3溶液 |
| B、先加入足量BaCl2溶液,过滤,再加入AgNO3溶液 |
| C、先加入足量稀H2SO4,再加入AgNO3溶液 |
| D、先加入稀盐酸,再加入AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )
用1.0mol?L-1NaOH溶液中和某浓度H2SO4溶液,其PH和所用NaOH溶液的体积关系如图所示,则原H2SO4溶液的物质的量浓度和完全反应后溶液的大致体积是( )| A、1.0mol?L-1、60mL |
| B、0.5mol?L-1、80mL |
| C、0.5mol?L-1、40mL |
| D、1.0mol?L-1、80mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,淀粉遇I- 变蓝色 |
| B、油脂水解可得到氨基酸和甘油 |
| C、所有烷烃和蛋白质中都只存在碳碳单键 |
| D、淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com