
【题目】298K时,在20mLbmol·L-1氧氧化钠溶液中滴入0.10mol·L-1的醋酸,溶液的pH与所加醋酸的体积关系如图所示。下列有关叙述正确的是

A. a<20
B. C点溶液中:c(CH3COO-)+c(CH3C00H)=c(Na+)
C. A、B、C、D四点水的电离程度大小顺序为:D>B>C>A
D. 醋酸的电离平衡常数Ka=2.0×10-7/(0.la-2)
【答案】D
【解析】A. NaOH溶液的pH=13,可知其浓度为0.1mol/L,若a=20mL,则恰好完全反应生成CH3COONa溶液,此时溶液显碱性,现B点溶液显中性,很明显a>20mL,故A错误;B. C点溶液显酸性,溶质为CH3COOH和CH3COONa,根据物料守恒可知c(CH3COO-)+c(CH3COOH)>c(Na+),故B错误;C. A点为强碱性溶液,对水的电离起抑制作用,B点溶液显中性,水正常电离,C、D点溶液显酸性,多余的酸抑制水的电离,滴加的酸越多抑制能力越强,则A、B、C、D四点水的电离程度大小顺序为B>C>D>A,故C错误;D. 在B点溶液pH=7,此时c(H+)=1×10-7mol/L,多余醋酸的物质的量浓度为(0.la-2)/(a+20)mol/L,根据电荷守恒可知溶液中c(CH3COO-)=c(Na+)=2/(a+20)mol/L,则此时醋酸的电离平衡常数Ka=[c(H+)×c(CH3COO-)]/c(CH3COOH)=2.0×10-7/(0.la-2),故D正确;答案为D。


科目:高中化学 来源: 题型:
【题目】2015年科学家首次利用X射线现测到化学反应过渡态的形成。在固体催化剂表面“抓取”CO分子和O原子,并“配对”生 成CO2分子,下列有关说法正确的是
A. CO与CO2均为酸性氧化物
B. 大量CO2的排放可导致酸雨的形成
C. CO与O形成化学键过程中有电子转移
D. 固体催化剂的使用会降低该反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答问题。
(1)乙烯的电子式为______________;
(2)当0.2mol烃A在足量氧气中完全燃烧时生成CO2和H2O各1.2mol,催化加氢后生成
2,2-二甲基丁烷,则A的结构简式为______________________________。
(3)某烃1mol与2molHCl完全加成,生成的氯代烷最多还可以与4molCl2反应,则该烃的结构简式为______________________。
(4)相对分子质量为72且沸点最低的烷烃的结构简式_______________________;
(5)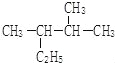 的名称(系统命名法)_______________________。
的名称(系统命名法)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学观或化学研究方法的叙述中,错误的是( )
A.在化工生产中应遵循“绿色化学”的思想
B.在过渡元素中寻找优良的催化剂
C.在元素周期表的金属和非金属分界线附近寻找半导体材料
D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分离方法不正确的是 ( )
A.用过滤的方法除去食盐水中的泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用淘洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均是短周期元素,其原子序数依次增大,A和B同周期,A和D同主族,A原子最外层电子数是内层电子数的二倍,B元素族序数是周期数的三倍,B的阴离子与C的阳离子电子层结构相同,C的单质与B的单质在不同条件下反应,可生成C2B或C2B2,E是所在周期中原子半径最小的元素。请回答:
(1)D在元素周期表中的位置是 。
(2)C2B的电子式是 ;AB2的结构式是 。
(3)B、C、E的离子半径由大到小的顺序为 (用化学式回答,下同);A、D、E元素最高价氧化物对应水化物的酸性由强到弱为 。
(4)B的气态氢化物与H2S相比沸点高的是 (用化学式回答);原因是 。
(5)水中锰含量超标,容易使洁具和衣物染色,使水产生异味,EB2可以用来除去水中超标的Mn2+,生成黑色沉淀MnO2,当消耗13.50gEB2时,共转移了1mol电子,则反应的离子方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com