
【题目】Fe、Co、Ni是三种重要的金属元素。回答下列问题:
(1)Fe、Co、Ni在周期表中的位置为_________,基态Fe原子的电子排布式为__________。
(2)CoO的面心立方晶胞如图所示。设阿伏加德罗常数的值为NA,则CoO晶体的密度为______g﹒cm-3:三种元素二价氧化物的晶胞类型相同,其熔点由高到低的顺序为_______。

(3)Fe、Co、Ni能与C12反应,其中Co和为Ni均生产二氯化物,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为____,Co(OH)3与盐酸反应有黄绿色气体生成,写出反应的离子方程式:______。
(4)95℃时,将Ni片浸在不同质量分数的硫酸中,经4小时腐蚀后的质量损失情况如图所示,当![]() 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为_____。由于Ni与H2SO4反应很慢,而与稀硝酸反应很快,工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,在硫酸中添加HNO3的方式为______(填“一次过量”或“少量多次”),此法制备NiSO4的化学方程式为_______。

【答案】第四周期第VIII族 1s22s22p63s23p63d64s2或[Ar]3d64s2 ![]() NiO>CoO>FeO CoCl3>Cl2>FeCl3 2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O 随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜 少量多次 3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O
NiO>CoO>FeO CoCl3>Cl2>FeCl3 2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O 随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜 少量多次 3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O
【解析】
(1)根据Fe、Co、Ni的原子序数得出位置和基态Fe原子的电子排布式。
(2)根据晶胞结构计算出O2和Co2+个数,根据密度公式计算;根据离子晶体键能和晶格能比较熔点。
(3)根据反应方程式氧化剂的氧化性大于氧化产物氧化性,Co(OH)3与盐酸反应发生氧化还原反应生成Cl2、CoCl2、H2O。
(4)类比Fe在常温下与浓硫酸发生钝化,根据图中信息得出原因;根据为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快这个信息得出添加硝酸的方法和反应方程式。
(1)Fe、Co、Ni分别为26、27、28号元素,它们在周期表中的位置为第四周期第VIII族,基态Fe原子的电子排布式为1s22s22p63s23p63d64s2或[Ar]3d64s2;故答案为:第四周期第VIII族;1s22s22p63s23p63d64s2或[Ar]3d64s2;。
(2)CoO的面心立方晶胞如图1所示。根据晶胞结构计算出O2个数为![]() ,Co2+个数为
,Co2+个数为![]() ,设阿伏加德罗常数的值为NA,则CoO晶体的密度为
,设阿伏加德罗常数的值为NA,则CoO晶体的密度为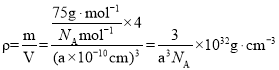 ;三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO;故答案为:
;三种元素二价氧化物的晶胞类型相同,离子半径Fe2+>Co2+>Ni2+,NiO、CoO、FeO,离子键键长越来越长,键能越来越小,晶格能按NiO、CoO、FeO依次减小,因此其熔点由高到低的顺序为NiO>CoO>FeO;故答案为:![]() ;NiO>CoO>FeO。
;NiO>CoO>FeO。
(3)Fe、Co、Ni能与Cl2反应,其中Co和为Ni均生产二氯化物,根据铁和氯气反应生成FeCl3,氧化剂的氧化性大于氧化产物氧化性,因此氧化性:Cl2>FeCl3,氯气与Co和为Ni均生产二氯化物,说明氯气的氧化性比CoCl3弱,由此推断FeCl3、CoCl3和Cl2的氧化性由强到弱的顺序为CoCl3>Cl2>FeCl3,Co(OH)3与盐酸反应有黄绿色气体生成,发生氧化还原反应生成Cl2、CoCl2、H2O,其离子方程式:2Co(OH)3+6H++2Cl-=Cl2↑+2Co2++6H2O;故答案为:CoCl3>Cl2>FeCl3;2Co(OH)3 +6H+ +2Cl-=Cl2↑+2Co2++6H2O。
(4)类比Fe在常温下与浓硫酸发生钝化,根据图中信息,当![]() 大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜。工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快,因此在硫酸中少量多次添加HNO3的方式来提高反应速率,反应生成NiSO4、H2O,根据硝酸浓度不同得到NO或NO2,此法制备NiSO4的化学方程式为3Ni+3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3 =NiSO4+2NO2↑+2H2O;故答案为:随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜;少量多次;3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O。
大于63%时,Ni被腐蚀的速率逐渐降低的可能原因为随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜。工业上选用H2SO4和HNO3的混酸与Ni反应制备NiSO4。为了提高产物的纯度,根据Ni与H2SO4反应很慢,而与稀硝酸反应很快,因此在硫酸中少量多次添加HNO3的方式来提高反应速率,反应生成NiSO4、H2O,根据硝酸浓度不同得到NO或NO2,此法制备NiSO4的化学方程式为3Ni+3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3 =NiSO4+2NO2↑+2H2O;故答案为:随H2SO4质量分数增加,Ni表面逐渐形成致密氧化膜;少量多次;3Ni +3H2SO4+2HNO3 =NiSO4+2NO↑+4H2O或Ni+H2SO4+2HNO3=NiSO4+2NO2↑+2H2O。


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:
【题目】2013年12月2日,“嫦娥三号”探测器由长征三号乙运载火箭从西昌卫星发射中心发射,首次实现月球软着陆和月面巡视勘察。“长征”系列火箭用偏二甲肼(C2H8N2)作燃料,四氧化二氮作氧化剂,生成氮气和二氧化碳气体。
(1)写出反应的化学方程式:_____________________________________________。
(2)该反应是________(填“放热”或“吸热”)反应,反应物的总能量________(填“大于”“小于”或“等于”)生成物的总能量,断开化学键________的总能量小于形成化学键________的总能量(填“吸收”或“放出”)。
(3)如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热是相同的,这个规律称为盖斯定律。据此回答下列问题。
已知:Na2CO3·10H2O(s)===Na2CO3(s)+10H2O(g)ΔH1=+532.36kJ·mol-1
Na2CO3·10H2O(s)===Na2CO3·H2O(s)+9H2O(g) ΔH2=+473.63kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
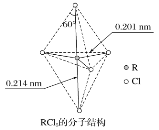
A.并不是每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能不都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】熔融钠-硫电池性能优良,是具有应用前景的储能电池。下图中的电池反应为![]() (x=5~3,难溶于熔融硫),下列说法错误的是
(x=5~3,难溶于熔融硫),下列说法错误的是
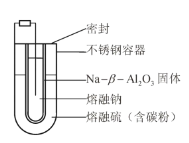
A.Na2S4的电子式为![]()
B.放电时正极反应为![]()
C.Na和Na2Sx分别为电池的负极和正极
D.该电池是以![]() 为隔膜的二次电池
为隔膜的二次电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是
A. CS2为V形的极性分子
B. ClO3—的空间构型为平面三角形
C. SF6中有6对相同的成键电子对
D. SiF4和SO32—的中心原子均为sp2杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在足量浓硝酸中加入3.84gCu片,反应完全后,将产生的气体(只含有一种气体)通入800mLH2O中充分反应,设反应前后溶液体积不变。
(1)写出产生的气体通入水中的化学反应方程式,并指出氧化剂与还原剂质量之比___;
(2)试求将气体通入水中充分反应后得到的溶液的物质的量浓度___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体的原子堆积方式常有以下四种,请认真观察模型(见图),回答下列问题:
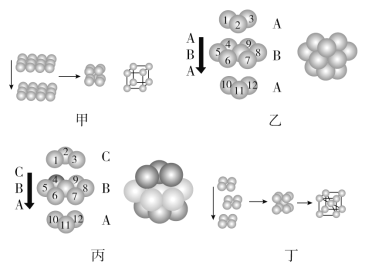
(1)四种堆积模型的堆积名称依次是________、________、________、________。
(2)甲堆积方式中的空间利用率为________,只有金属________采用这种堆积方式。
(3)乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________。
(4)采取丁中堆积方式的金属通常有________(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
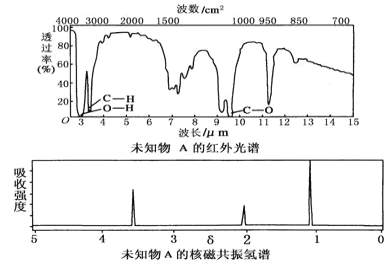
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com